
【题目】乙醇(C2H5OH)燃料电池(DEFC)具有很多优点,引起了人们的研究兴趣。现有以下三种乙醇燃料电池。

(1)三种乙醇燃料电池中正极反应物均为_________________。(填化学式)
(2)熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电池工作时,CO32-向电极___(填“a”或“b”)移动。
(3)酸性乙醇燃料电池中,若电池消耗标准状况下2.24L O2,则电路中通过了的电子数目为___________。
【答案】O2 a 0.4NA
【解析】
(1)燃料电池中,负极通入燃料,正极通入氧化剂;
(2)根据装置图可知,a为负极,原电池中阴离子由正极向负极移动;
(3)酸性乙醇燃料电池中,电极b上发生的电极反应为:3O2+12H++12e-=6H2O,根据电极反应计算转移的电子的数目。
(1)燃料电池中,负极通入燃料,正极通入氧化剂,由装置图可知,三种乙醇燃料电池中正极反应物均为O2;
(2)根据装置图可知,a为负极,原电池中阴离子由正极向负极移动,因此CO32-向电极a移动;
(3)酸性乙醇燃料电池中,电极b上发生的电极反应为:3O2+12H++12e-=6H2O,若电池消耗标准状况下2.24L (即0.1mol)O2时,电子转移0.4mol,转移电子的数目为0.4NA。


科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关。下列说法错误的是![]()
![]()
A.泡沫灭火器可用于一般的起火,也适用于电器起火
B.绿色化学要求从源头上消除或减少生产活动对环境的污染
C.锅炉水垢中含有的![]() ,可先用
,可先用![]() 溶液处理,后用酸除去
溶液处理,后用酸除去
D.电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁铝水滑石(Mg2Al(OH)6ClxH2O)是一种人工合成的新材料.它在高温下完全分解MgO、Al2O3、HCl和水蒸气.用如图所示的装置进行实验以确定其化学式.完成下面小题。

【1】若只通过测定装置中C、D的增重来确定x,则装置按气流方向接口的连接顺序为
A.a→b→c→eB.a→c→b→dC.a→e→d→bD.a→d→e→c
【2】加热前通N2,称取C、D的初始质量后,再持续通N2。对通N2作用叙述错误的是
A.加热前通,为排尽装置中空气
B.持续通,为将产生的气体被C、D完全吸收
C.持续通,为防止倒吸
D.持续通,为防止MgO、Al2O3和氧气反应
【3】完全分解后测得C增重3.65g、D增重9.90g,则x的值是
A.2B.3C.4D.5
【4】若气体温度过高,则不易被液体充分吸收,冷却玻管B能降低气体的温度,但不能液化水蒸气。若取消B后进行实验,测定的x值将
A.偏低B.偏高C.无影响D.无法确定
【5】上述镁铝水滑石在空气中放置时易发生反应生成Mg2Al(OH)6Cl1﹣2y(CO3)yzH2O,该生成物也能发生类似的热分解反应,现以此物为样品,用上述装置和试剂进行实验测定z,除测定D的增重外,至少还需测定
A.样品的质量
B.装置C的增重
C.样品的质量和装置C的增重
D.样品分解后残余物质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将金属M的样品2.5g放入50g 19.6%的硫酸溶液中,恰好完全反应(样品中的杂质既不溶于硫酸,也不与其发生反应),生成硫酸盐。实验测知,此硫酸盐中硫、氧元素的质量分数之和为80 %。试求:
(1)原金属样品中,金属M的质量分数_____
(2)M的相对原子质量__________
(3)反应所得的硫酸盐溶液中溶质的质量分数___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝氢化钠(NaAlH4)是有机合成的一种重要还原剂。一般的制备方法是将AlC13溶于有机溶剂,再把所得溶液滴加到NaH粉末上,可制得铝氢化钠。实验要求和装置如下,回答下列问题:
(1)制取铝氢化钠要在非水溶液中进行,主要原因是_______(用化学方程式表示)。用下列装置制取少量铝氢化钠(含副产物处理)较为合理的是__________。

(2)对于原料A1C13的制取,某兴趣小组设计了如下装置:
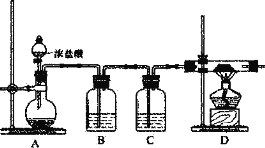
①连接好装置后,应进行的第一步操作是_________;为保证产物的纯净,应待D中__________(填现象)再加热酒精灯。
②B装置中盛装饱和NaCl溶液,实验开始后B中产生的现象是_________,选择饱和NaCl溶液的理由是_____。
③C装置的作用是_________;若无C装置,试预测实验后D中生成物除A1C13外可能还含有_________。(填化学式)
④上述装置存在的明显缺陷是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下HF的电离常数Ka=3.3×10-4 mol·L-1,CaF2的溶度积常数Ksp=1.46×10-10(mol·L-1)3。在该温度下取浓度为0.31 mol·L-1的HF与浓度为0.002 mol·L-1的CaCl2溶液等体积混合。下列说法正确的是( )
A.该温度下,0.31 mol·L-1的HF溶液的pH=2
B.升高温度或增大浓度,HF的电离平衡常数都将增大
C.两溶液混合不会产生沉淀
D.向饱和的CaF2溶液中加水后,c(Ca2+)一定比加水前减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁是一种重要的金属资源,工业上制取镁单质主要是电解法。
(1)电解法制取镁单质的反应方程式是:___。
(2)电解原料无水氯化镁可由海水制备。主要有以下步骤:①在一定条件下脱水干燥;②海水中加熟石灰;③加盐酸;④过滤;⑤蒸发浓缩冷却结晶。其步骤先后顺序是___(步骤可重复使用),
(3)上述步骤①中“一定条件下”具体是指:___,其目的是___。
(4)已知某温度下Mg(OH)2的Ksp=6.4×l012,当溶液中c(Mg2+)≤1.0×105mol·L1可视为沉淀完全,则此温度下应保持溶液中c(OH-)≥___mol·L1。
(5)将饱和NH4Cl溶液滴入少量的Mg(OH)2悬浊液中,可看到白色沉淀溶解溶液变澄清。反应原理可能有两方面,请分别用离子方程式表示:
①____;
②____。
要验证①②谁是Mg(OH)2溶解的主要原因,可选取___代替NH4Cl溶液作对照实验。
A.NH4NO3 B.(NH4)2SO4 C.CH3COONH4 D.NH4HCO3
(6)镁电池是近年来科学技术研究的热点之一。一种“镁—次氯酸盐”电池的总反应为:Mg+ClO-+H2O=Mg(OH)2+Cl-。其工作时正极的电极反应式:___;用此镁电池给铅蓄电池充电,下列说法中正确的是___。
A.镁电池正极与铅蓄电池正极相连
B.电子从Pb电极转移到镁电池负极
C.充电后,铅蓄电池两极质量均减小,理论上镁电池消耗24gMg,阴、阳极的质量变化之比为3︰2
D.充电后,镁电池和铅蓄电池的pH均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 蛋白质、纤维素、蔗糖、![]() 、淀粉都是高分子化合物
、淀粉都是高分子化合物
B. 蔗糖在人体内水解的产物只有葡萄糖
C. 使用太阳能热水器、沼气的利用、玉米制乙醇都涉及到生物质能的利用
D. 石油、煤、天然气、可燃冰都是化石燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种碳纳米管能够吸附氢气,用这种材料制备的电池其原理如图所示,该电池的电解质为6mol·L-1KOH溶液。下列说法中不正确的是( )

A.放电时镍电极作负极
B.放电时K+移向正极
C.放电时碳电极的电极反应为H2-2e-+2OH-=2H2O
D.该反应过程中KOH溶液的浓度基本保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com