
| A. | 量筒 | B. | 酒精灯 | C. | 温度计 | D. | 环形玻璃搅拌棒 |
科目:高中化学 来源: 题型:解答题
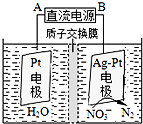 为治理环境,减少雾霾,工业上通常用下列方法治理CO2和硫、氮氧化物的污染.
为治理环境,减少雾霾,工业上通常用下列方法治理CO2和硫、氮氧化物的污染.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 括号内为杂质 | 除杂试剂 | 除杂操作 |
| A | Na2O2(Na2O)固体 | O2 | 在纯氧气中加热 |
| B | Na2CO3(NaHCO3) 溶液 | CO2 | 通入过量的CO2 |
| C | FeCl3(FeCl2)溶液 | Cl2 | 通入过量的Cl2 |
| D | FeSO4(CuSO4)溶液 | Fe | 加入过量的Fe粉,充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8 g Na2O2中含有的阴离子数目为0.2NA | |
| B. | 足量Zn与一定量的浓硫酸反应,产生22.4L(标准状况)气体时转移的电子数一定为2NA | |
| C. | 1 L 0.1 mol/L Al2(SO4)3溶液中,Al3+的数目为0.2NA | |
| D. | 氢氧燃料电池正极消耗22.4L气体时,电路中通过的电子数目为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用分液漏斗前应先检查其是否漏液 | |
| B. | 可以选用苯、汽油、酒精和四氯化碳为萃取剂 | |
| C. | 若用四氯化碳为萃取剂,将两种液体混合,充分振荡,静置,分层后,下层液体呈紫红色 | |
| D. | 分层后,打开分液漏斗活塞,使全部下层液体沿承接液体的烧杯内壁流出,然后上层液体从漏斗上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若a=b+c时,B的物质的量分数不变 | B. | 若a<b+c时,A的转化率减小 | ||
| C. | 若a<b+c时,B的物质的量浓度减小 | D. | 若a>b+c时,A的物质的量分数减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应过程中,化合价发生变化的元素是镍、镧 | |
| B. | 该电池放电时,负极反应为:LaNi5H6+6OH--6e-=LaNi5+6H2O | |
| C. | 市面上出售的标称容量为 2000 mA•h的1节镍氢电池至少应含有镧镍合金5.4 g(已知 1法拉第电量为96500库仑或安培•秒) | |
| D. | 充电电池放电后可以再充电使活性物质获得再生,但实际上充放电次数仍有限制 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com