
下列进行性质比较的实验,不合理的是
A.比较Cu、Fe的还原性:铜加入硫酸铁溶液中
B.比较氯的非金属性强于溴:溴化钠溶液中通入氯气
C.比较高锰酸钾的氧化性强于氯气:高锰酸钾中加入浓盐酸
D.比较镁的金属性强于铝:取一小段去氧化膜的镁带和铝片,分别加入1.0 mol·L-1的盐酸中
科目:高中化学 来源:2013-2014学年广东省十校联考高三下学期理综化学试卷(解析版) 题型:填空题
(16分)香豆素(结构如下图中Ⅰ所示)是用途广泛的香料,由香豆素经下列图示的步骤可转变为水杨酸。
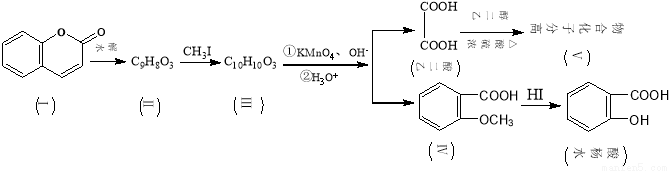 已知:CH3CH=CHCH2CH3
已知:CH3CH=CHCH2CH3 CH3COOH+CH3CH2COOH
CH3COOH+CH3CH2COOH
请回答下列问题:
(1)化合物Ⅱ分子中的含氧官能团的名称为 ,由乙二酸生成高分子化合物Ⅴ的反应类型为。
(2)下列关于有机物Ⅰ、Ⅱ、Ⅲ、Ⅳ的叙述中正确的是(选填编号)
A.1molⅠ最多能和5mol H2发生加成反应B.可用FeCl3溶液来鉴别Ⅱ和Ⅲ
C.Ⅳ中核磁共振氢谱共有4种峰 D.Ⅰ、Ⅱ、Ⅲ均可使溴的四氯化碳溶液褪色
(3)香豆素在过量NaOH溶液中完全水解的化学方程式为
(4)Ⅲ的结构简式为 ,在上述转化过程中,设计反应步骤Ⅱ→Ⅲ的目的是 。
(5)化合物Ⅳ有多种同分异构体,请写出其中一种符合下列条件的同分异构体的结构简式: 。
①是苯的对位二取代物;②水解后生成的产物之一能发生银镜反应。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省德州市高三4月模拟考试(二模)理综化学试卷(解析版) 题型:选择题
下列有关叙述不正确的是
A.MgO、Al2O3熔点高,可用于制作耐火材料
B.用浓氢氧化钠溶液可除去乙酸乙酯中混有的乙酸、乙醇杂质
C.除去NaCl溶液中的Na2CO3,应选择试剂为盐酸,而不是硝酸
D.油脂在碱性条件下易发生水解,可用于制作肥皂
查看答案和解析>>
科目:高中化学 来源:2013-2014学年天津市七校高三4月联考理综化学试卷(解析版) 题型:选择题
常温下,用0.1000 mol·L-1 NaOH溶液分别滴定20.00 mL 0.1000 mol·L-1 盐酸和20.00 mL 0.1000 mol·L-1醋酸溶液,得到两条滴定曲线,如下图所示,若以HA表示酸,下列说法正确的是
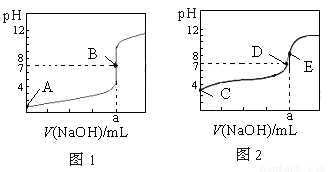
A.滴定盐酸的曲线是图2
B.达到B、E状态时,反应消耗的n(CH3COOH)>n(HCl)
C.达到B、D状态时,两溶液中离子浓度均为c(Na+)=c(A-)
D.当0 mL<V(NaOH)<20.00 mL时,对应混合液中各离子浓度大小顺序为c(A-)>c(Na+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京顺义区高三第二次统练理综化学试卷(解析版) 题型:填空题
工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素。霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
(1)SO2在烟尘的催化下形成硫酸的反应方程式是__________。
(2)NOx和SO2在空气中存在下列平衡:
2NO(g)+ O2(g) 2NO2(g) △H= -113.0 kJ·mol-1
2NO2(g) △H= -113.0 kJ·mol-1
2SO2(g)+ O2 (g) 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1
SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3。
①写出NO2和SO2反应的热化学方程式为________。
②随温度升高,该反应化学平衡常数变化趋势是________。
(3)提高2SO2 + O2  2SO3反应中SO2的转化率,是减少SO2排放的有效措施。
2SO3反应中SO2的转化率,是减少SO2排放的有效措施。
①T温度时,在1L的密闭容器中加入2.0 mol SO2和1.0 mol O2,5 min后反应达到平衡,二氧化硫的转化率为50%,该反应的平衡常数是_______。
②在①中条件下,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是_______(填字母)。
a.温度和容器体积不变,充入1.0 mol He
b.温度和容器体积不变,充入1.0 mol O2
c.在其他条件不变时,减少容器的体积
d.在其他条件不变时,改用高效催化剂
e.在其他条件不变时,升高体系温度
(4)工业上利用氯碱工业产品治理含二氧化硫的废气。如图是氯碱工业中电解饱和食盐水的原理示意图。
①电解饱和食盐水的化学方程式是 。
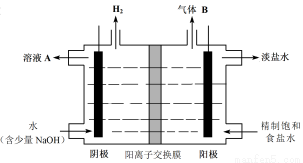
②用溶液A吸收含二氧化硫的废气,其反应的离子方程式是 。
③用含气体B的阳极区溶液吸收含二氧化硫的废气,其反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市通州区高三年级模拟考试(一)理综化学试卷(解析版) 题型:填空题
碱式氯化铝[ Al2(OH)nCl6-n ] 是利用工业铝灰和活性铝矾土为原料(主要含Al、Al2O3、SiO2及铁的氧化物)经过精制加工而成,此产品活性较高,对工业污水具有较好的净化效果。其制备流程如下:
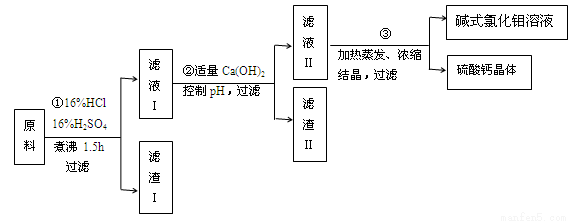
(1)原料需要粉碎,其目的是 ;滤渣I的主要成分是 ;
(2)步骤①在煮沸过程中,溶液逐渐变为浅绿色,此时溶液中呈浅绿色的阳离子常采用加入 试剂进行检验(填化学式);随后溶液又变为棕黄色,相关反应的离子方程式为 ;
(3)步骤②中加入适量的Ca(OH)2并控制pH,其目的:一是生成碱式氯化铝;二是 ;已知碱式氯化铝的分散质粒子大小在1~100 nm之间,则区别滤液I与碱式氯化铝两种液体的物理方法是 ;若Ca(OH)2溶液过量,则步骤③得到的碱式氯化铝产率偏低,该反应的离子方程式为 ;
(4)某温度下若0.1 mol AlCl3溶于蒸馏水,当有2.5%水解生成Al(OH)3溶液时,吸收热量Q kJ ,该过程的热化学反应方程式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市通州区高三年级模拟考试(一)理综化学试卷(解析版) 题型:选择题
下列反应的离子方程式书写正确的是
A.电解饱和食盐水:2Cl-+ 2H2O 2OH-+ H2↑+ Cl2↑
2OH-+ H2↑+ Cl2↑
B.醋酸除去水垢中的CaCO3:CaCO3 + 2H+=Ca2+ + H2O + CO2↑
C.漂白粉溶液在空气中失效:ClO-+ CO2 + H2O=HClO + HCO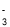
D.向NaHSO4溶液中滴加NaHCO3溶液:HSO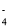 + HCO
+ HCO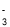 = H2O + SO
= H2O + SO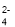 + CO2↑
+ CO2↑
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市丰台区高三下学期统一练习(一)化学试卷(解析版) 题型:填空题
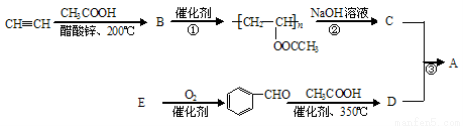
聚乙烯醇肉桂酸酯(A)可用于光刻工艺中做抗腐蚀涂层。下面是一种合成该有机物的路线:
已知: 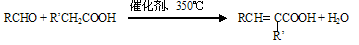
请回答:
(1)CH3COOH中的含氧官能团的名称为 ;其电离方程式是______。
(2)反应①是加聚反应,B的结构简式是 。
(3)反应②的反应类型是 。
(4)E的分子式为C7H8O,符合下列条件的E的同分异构体的结构简式是 。
① 能与浓溴水反应产生白色沉淀 ②核磁共振氢谱有4种峰
(5) 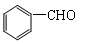 能与新制的Cu(OH)2反应,该反应的化学方程式是 。
能与新制的Cu(OH)2反应,该反应的化学方程式是 。
(6)关于D的性质下列说法正确的是 (填字母)。
a.存在顺反异构
b.溶液呈酸性,能与Na和NaOH溶液反应
c.能使KMnO4(H+)溶液和Br2(CCl4)溶液褪色
d.能发生银镜反应、酯化反应、加成反应和消去反应
(7)反应③的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市徐汇、松江、金山三区高三二模化学试卷(解析版) 题型:实验题
某研究性学习小组通过下列实验探究SO2能否与BaCl2溶液反应生成BaSO3沉淀,并制备硫酸铜晶体。完成下列填空。甲同学用装置I进行实验,加热反应物至沸腾,发现BaCl2溶液中出现白色沉淀,且白色沉淀不溶于盐酸。
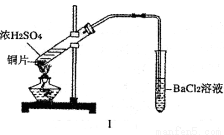
(1)白色沉淀是 。
(2)甲同学就白色沉淀的生成原因提出了两种假设,这两种假设可能是:
① ②
乙同学设计了改进装置Ⅱ进行实验,检验甲同学提出的假设(夹持装置和A中加热装置已略,气密性已检验)。
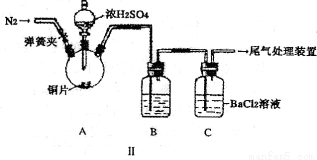
①打开弹簧夹,通入N2一段时间后关闭弹簧夹;
②滴加一定量浓硫酸,加热A,一段时间后C中未见沉淀生成。
(3)操作①的目的是 ,集气瓶B中的试剂是 。
(4)该实验能否检验甲同学上述两种假设中的任意一种 ,理由是 。
丙同学向反应后的蓝色溶液中加入足量的CuO,过滤后将滤液制成硫酸铜晶体(CuSO4·xH2O),采用加热法测定该晶体中结晶水x的值,实验数据记录如下:
坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 | |
第一次称量 | 第二次称量 | ||
11.710g | 22.700g | 18.621g | a |
(5)若无需再进行第三次称量,则a的数值范围应为 。
(6)若加热后坩埚与固体总质量为18.620g,计算x 的实测值 (保留二位小数),相对误差 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com