
| A. | 分子式为C4H10O的醇,能在铜催化和加热条件下被氧气氧化为醛的同分异构体共有4种 | |
| B. | 2-氯丁烷与NaOH乙醇的溶液共热的反应产物中一定不存在同分异构体 | |
| C. | 3-甲基-3-乙基戊烷的一氯代物有5种 | |
| D. | 分子式为C7H8O的有机物,能与氯化铁溶液发生显色反应的同分异构体共有3种 |
分析 A.分子式为C4H10O的醇,能在铜催化和加热条件下被氧气氧化为醛,说明与羟基相连的碳上有2个氢原子,即具有-CH2OH结构的醇,根据-C3H7同分异构体来解答;
B.根据消去反应的实质是和相邻碳原子上的氢原子消去小分子形成双键分析判断;
C.根据等效H原子判断,有几种H原子,一氯代产物有几种同分异构体.
D.分子式为C7H8O的有机物,能与氯化铁溶液发生显色反应,故含有1个苯环,1个酚羟基,还含有1个甲基,结合甲基与酚羟基的位置关系解答.
解答 解:A.分子式为C4H10O的醇,能在铜催化和加热条件下被氧气氧化为醛,说明与羟基相连的碳上有2个氢原子,丙基-C3H7可能的结构有:-CH2CH2CH3、-CH(CH3)CH3,所以该有机物的可能结构有2种,故A错误;
B.2-氯丁烷(CH3CH2CClHCH3)与NaOH乙醇溶液共热发生消去HCl分子的反应,可以从1号碳上消去氢原子形成双键,也可以从3号碳原子上消去氢原子形成双键,所以反应产物中有两种不同的同分异构体,故B错误;
C.3-甲基-3-乙基戊烷(CH3CH2)2CCH3CH2CH3有3种H原子,一氯代物有3种同分异构体,故C错误;
D.分子式为C7H8O的有机物,能与氯化铁溶液发生显色反应,故含有1个苯环,1个酚羟基,还含有1个甲基,甲基与酚羟基有邻、间、对三种位置关系,故同分异构体共有3种,故D正确;
故选D.
点评 本题考查同分异构体、有机物结构的推断、官能团的性质等,难度不大,明确官能团的性质是解题关键.


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:选择题
| 实验事实 | 结论或原因 | |
| A | SO2的水溶液可以导电 | SO2是电解质 |
| B | 漂白粉在空气中久置变质 | 漂白粉中的Ca(ClO)2与空气中的CO2反应生成CaCO3和见光易分解的HClO |
| C | 石灰石与二氧化硅在高温下反应可制得硅酸钙 | 非金属性:Si>C |
| D | 碳酸氢钠可用作食品的膨松剂 | 碳酸氢钠能与碱反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
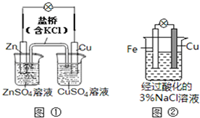
| A. | 图①中正极附近溶液pH降低 | |
| B. | 图①中电子由Zn流向Cu,盐桥中的Cl-移向CuSO4溶液 | |
| C. | 图②中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成 | |
| D. | 图②正极反应是O2+2H2O+4e-═4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向沸水中滴加饱和氯化铁溶液制备胶体,用可见光束照射,产生丁达尔效应 | |
| B. | 常温下,向0.10mol•L-1NaHCO3溶液,滴加CaCl2溶液至pH=7,滴加过程中产生白色沉淀,但无气体放出,说明加入CaCl2促进了HCO3-的水解 | |
| C. | 利用以下实验器材(规格数量不限):烧杯、量筒、环形玻璃搅拌棒、纸条、硬纸板、温度计能完成中和反应反应热的测定 | |
| D. | 向浓度均为0.1mol•L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,先出现蓝色沉淀,因为KSP[Mg(OH)2]>KSP[Cu(OH)2] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,测得氯化铵溶液pH<7,证明一水合氨是弱碱:NH4++2H2O═NH3•H2O+H3O+ | |
| B. | 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-═Fe3+ | |
| C. | 用铂做电极,KOH溶液作电解质溶液,甲烷燃料电池的总反应:CH4+2O2═CO2+2H2O | |
| D. | 铅蓄电池充电时接直流电源的正极反应:PbSO4+2H2O-2e-═PbO2+4H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
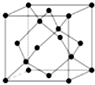 A、B、C、D、E、F为原子序数依次增大的六种元素,A的一种同位素可用于考古测定生物的死亡年代,C原子的最外层电子数是次外层的3倍,D与B同主族;E的原子序数是A、B之和的2倍;F的原子序数为29.回答下列问题:
A、B、C、D、E、F为原子序数依次增大的六种元素,A的一种同位素可用于考古测定生物的死亡年代,C原子的最外层电子数是次外层的3倍,D与B同主族;E的原子序数是A、B之和的2倍;F的原子序数为29.回答下列问题: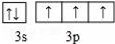 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 决定物质性质的重要因素是物质结构.请回答下列问题.
决定物质性质的重要因素是物质结构.请回答下列问题.| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com