
| A. | CH2=CH2 | B. | CH3COOH | C. | CH2=CHClC=CH2 | D. | CH2=CHCH2OH |
分析 当线型高分子链上如果还有能起反应的官能团时,在一定条件下就会形成体型高分子结构,说明该分子中应该含有两个官能团或两种官能团且这两种官能团必须能形成高分子化合物,据此分析解答.
解答 解:当线型高分子链上如果还有能起反应的官能团时,在一定条件下就会形成体型高分子结构,说明该分子中应该含有两个官能团或两种官能团且这两种官能团必须能形成高分子化合物,AB只含一种官能团,所以不能形成体型高分子化合物,C中含有两个官能团、D中含有两种官能团,且这两种化合物在形成高分子化合物时还能发生加聚反应或缩聚反应,所以能形成体型高分子化合物,故选CD.
点评 本题考查有机物结构和性质,为高频考点,明确题给信息是解本题关键,知道形成体型高分子化合物所需条件即可解答,题目难度不大.


科目:高中化学 来源: 题型:解答题
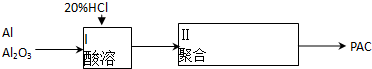
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
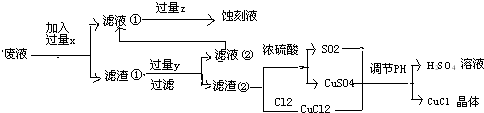
| 1 | 2 | 3 | |
| 空白实验消耗硫酸铈标准溶液的体积(mL) | 0.75 | 0.50 | 0.80 |
| 0.25克样品消耗硫酸铈标准溶液的体积(mL) | 24.65 | 24.75 | 24.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的最简式:CH2=CH2; 对甲基苯甲醇的结构简式: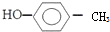 | |
| B. | Cl-的结构示意图: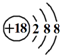 甲烷分子的球棍模型: 甲烷分子的球棍模型: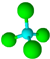 | |
| C. | HCO3-的水解方程式为:HCO3-+H2O?CO32-+H3O+ | |
| D. | 羟基的电子式: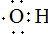 原子核内有20个中子的氯原子:${\;}_{17}^{37}$Cl 原子核内有20个中子的氯原子:${\;}_{17}^{37}$Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁表面镀锌,锌作阳极 | |
| B. | 船底镶嵌锌块,锌作正极,以防船体被腐蚀 | |
| C. | 钢铁吸氧腐蚀的正极反应:O2+2H2O+4e-═4OH- | |
| D. | 工业上电解饱和食盐水的阳极反应:2Cl--2e-═Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na→NaOH→Na2CO3→NaCl | B. | Al→Al2O3→Al(OH)3→AlCl3 | ||
| C. | Mg→MgCl2→Mg(OH)2→MgSO4 | D. | Fe→FeCl2→Fe(OH)2→Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌粒与醋酸反应:Zn+2H+═Zn2++H2↑ | |
| B. | 铁粉与氯化铁溶液反应:Fe+Fe3+═2Fe2+ | |
| C. | 常温下氯气与烧碱溶液反应:Cl2+2OH-═Cl-+ClO-+H2O | |
| D. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
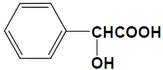 扁桃酸是重要的医药和染料中间体,其应用非常广泛.扁桃酸的结构简式如图所示.
扁桃酸是重要的医药和染料中间体,其应用非常广泛.扁桃酸的结构简式如图所示.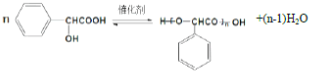 .
.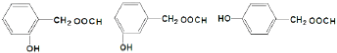 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com