
【题目】当光束通过下列物质:①尘埃的空气 ②氢氧化钠溶液 ③蒸馏水 ④淀粉溶液,能观察到有丁达尔现象的是
A. ①② B. ②③ C. ①④ D. ②④
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)为一元酸,具有较强的还原性。可利用NaH2PO2为原料,通过四室电渗析法制备,工作原理如图所示,采用惰性电极,ab,cd,ef均为只允许阳离子(或阴离子)通过的离子交换膜,分别称为阳膜(或阴膜),下列说法描述错误的是

A. 阳极室反应为:2H2O-4e-=O2↑+4H+
B. ab,ef均为阳膜,cd为阴膜
C. 若将稀H2SO4改为H3PO2,撤去ab膜,产品中总混有杂质的原因是:H3PO2在阳极放电而被氧化生成H3PO4
D. 通电后产品室中的H+离子向原料室迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辣椒中含辣椒素,局部应用可助减轻疼痛。辣椒素酯类化合物的结构可以表示为: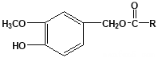 (R为烃基),其中一种辣椒素酯类化合物J的合成路线如下:
(R为烃基),其中一种辣椒素酯类化合物J的合成路线如下:
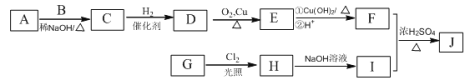
已知:
①A、B和E为同系物,其中B的相对分子质量为44,A和B核磁共振氢谱显示都有两组峰,峰面积比分别为9:1和3:1;
②化合物J的分子式为C15H22O4;
③
回答下列问题:
(1)G中含有的官能团有 、 。
(2)由C生成D的反应类型为 ,D的化学名称为 。
(3)①的化学方程式为 。
(4)J的结构简式为 。
(5)G的同分异构体中,苯环上的一氯代物只有一种的共有 种(不含立体异构),核磁共振氢谱显示2组峰的是 (写结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分:
碳 | 氮 | Y | |
X | 硫 | Z |
请回答下列问题:
(1)Z元素在周期表中的位置为________________。
(2)表中元素原子半径最大的是(写元素符号)________________。
(3)下列事实能说明Y元素的非金属性比硫元素的非金属性强的是________(填序号)。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1mol硫得电子多
c.Y和硫两元素的简单氢化物受热分解,前者的分解温度高
(4)现有一定量的铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由上表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1L2.2mol·L-1 NaOH溶液和1molO2,则两种气体的分子式及物质的量分别为______________________________,生成硫酸铜物质的量为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 把煤作为燃料可通过下列两种途径:
途径I:直接燃烧C(s)+O2(g)═CO2(g)(放热Q1kJ)
途径II:先制成水煤气:C(s)+H2O(g)═CO(g)+H2(g)(吸热Q2kJ)
再燃烧水煤气:2CO(g)+O2(g)═2CO2(g)
2H2(g)+O2(g)═2H2O(g)(共放热Q3kJ)
试回答下列问题:
①判断两种途径放出热量大小:途径I ______(填“大于”、“等于”或“小于”)途径II
②Q 1、Q 2 、Q 3 的数学关系式是________________________。
③已知1 g氢气完全燃烧生成液态水时放出热量143 kJ,18 g水蒸气变成液态水放出44 kJ的热量。
其他相关数据如下表:则表中x的值为_____________。
O===O | H—H | H—O(g) | |
1 mol化学键断裂时需要吸收的能量/kJ | 496 | 436 | x |
④简述煤通过途径Ⅱ作为燃料的意义:______________________________

(2)化学反应可视为旧键断裂和新键形成的过程。如图为白磷(P4)和P4O6分子的分子结构示意图,其他相关数据如下表所示。则反应P4 +3O2 = P4O6的热量变化为:__________________。
O===O | P—P | P—O | |
1 mol化学键断裂时需要吸收的能量/kJ | 496 | 198 | 360 |
(3)下列变化中属于放热反应的是______
A.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应
B.镁条与二氧化碳反应
C.干冰升华为气体
D.碳酸钙高温锻烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是不完整的元素周期表。A~H八种元素的位置已确定,完成下列各题。
A | |||||||||||||||||
B | C | D | |||||||||||||||
E | F | G | |||||||||||||||
H | |||||||||||||||||
(1)用实线画出元素周期表的上边界。用阴影表示出非金属元素。(请用黑色水笔书写)__________
(2)用一个置换反应证明F和G的非金属性强弱:(书写离子方程式)_____________。
(3)已知A和C能形成含有18个电子的化合物,其含有的化学键的类型为__________、__________。
(4)已知A和C也能形成CA5的离子化合物,请书写其电子式__________________。
(5)H能与C的最高价氧化物对应的水化物的稀溶液反应,写出反应的离子方程式________________。
(6)判断B的氢化物和E的氢化物的沸点高低:BHm_____________EHm(填“大于”、“等于”或“小于”)。
(7)C的氢化物极易溶于D的氢化物的原因是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为了探究碳酸钙与稀盐酸反应过程中的速率变化,在VmL稀盐酸中加入足量的碳酸钙,收集反应放出的CO2(气体体积已换算为标准状况下的数值),实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
CO2体积(mL) | 50 | 120 | 232 | 290 | 310 |
(1)0~1 min、1~2 min、2~3 min、3~4 min、4~5 min五个时间段中,_________反应速率最快。
(2)假设溶液体积不变,4~5min时间段以盐酸的浓度变化来表示的该反应速率为____________________________。
(3)为了降低上述化学反应的反应速率,向溶液中加入下列物质,你认为可行的是
_______________(填编号)。
a.蒸馏水 b.浓盐酸 c.NaCl固体 d.NaCl溶液
(4)除了上述方法外,你认为还可以采取哪些措施来降低化学反应速率?(试写两条)_______________________________________________________________________,
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 下列事实不能用勒夏特列原理解释的是 ( )
A.合成氨工业上增大压强以提高反应物的转化率
B.黄绿色的氯水光照后颜色变浅
C.由H2、I2蒸气、HI组成的平衡体系加压后颜色变深
D.在含有Fe(SCN)2+的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近些年,半导体材料在电子领域发展迅速,科学家一般在分界线出寻找半导体材料,如硅、锗、砷及GaAs等化合物。回答下列问题:
(1)基态As原子的外围电子排布式为________,原子核外有______个未成对电子。
(2)实验测得镓的氯化物的熔沸点显著低于其对应化合价的氯化物,其原因可能是_________。
(3)Ge、Se、As位于周期表第四周期,其第一电离能由大到小的顺序为______。
(4)AsH3分子的立体构型为 ______,其中As的杂化轨道类型为______。
(5)碳和硅属于同主族元素,碳能形成多种氢化物,但硅的氢化物很少且不稳定,试从原子结构角度分析可能的原因__________。
(6)GaAs晶胞结构如图所示,若A的坐标参数为(0,0,0),B为(0,1/2,1/2)、C为(1,0,0)、则D的坐标参数为_______。已知GaAs的晶胞边长为apm,其密度为_____ g·cm-3(列出计算式即可)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com