

| A.甲和丙中同种元素化合价不可能相等 |
| B.该反应属于氧化还原反应 |
| C.丁物质一定是非金属单质 |
| D.配平后甲、乙、丙的化学计量数均为2 |
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源:不详 题型:填空题
| A.Na2CO3 | B.KMnO4 | C.XeO3 | D.Na2SO3 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| A.NaCl、Cl2 | B.NaCl、NaClO | C.NaClO3、NaClO4 | D.NaCl、NaClO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.二氧化硫通入氯水中 | B.氯气通入氢氧化钠溶液中 |
| C.氯气通入氯化亚铁溶液中 | D.氨气通入水中 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2Na+2H2O=2NaOH+ H2↑ |
| B.2Na2O2+2 CO2=2 Na2CO3+ O2 |
| C.NaH+ H2O = NaOH+ H2↑ |
| D.ICl+H2O=HCl+HIO (ICl中Cl为-1价) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
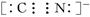 。它与硫酸反应的化学方程式为K4Fe(CN)6+6H2SO4+6H2O
。它与硫酸反应的化学方程式为K4Fe(CN)6+6H2SO4+6H2O 2K2SO4+FeSO4+3(NH4)2SO4+6CO↑
2K2SO4+FeSO4+3(NH4)2SO4+6CO↑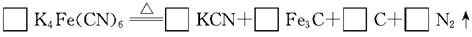
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.9 mol | B.0.45 mol | C.0.3 mol | D.0.1 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.物质氧化性:X2>Z2>Y2 | B.物质的还原性:HY>HZ>HX |
| C.反应Y2 +2HX = 2HY+ X2也能发生 | D.Z2可能有氧化性,也可能有还原性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com