
| A. | c1>2c2 | B. | c2=2c1 | C. | c2<c1<2c2 | D. | c1=2c2 |
分析 乙醇溶液的密度小于水,乙醇溶液的浓度越大,其密度越小,根据c=$\frac{1000ρω}{M}$可得:c1=$\frac{1000{ρ}_{1}×2w}{46}$、c2=$\frac{1000ρω}{46}$,据此进行判断.
解答 解:设物质的量是浓度为c1 mol•L-1的乙醇的密度为ρ1,物质的量是浓度为c2mol•L-1乙醇溶液的密度为ρ2,
则:c1=$\frac{1000{ρ}_{1}×2w}{46}$、c2=$\frac{1000ρω}{46}$,所以$\frac{{c}_{1}}{{c}_{2}}$=$\frac{2{ρ}_{1}}{{ρ}_{2}}$,
因乙醇溶液的浓度越大,其密度越小,则ρ1<ρ2,
所以c1<2c2,
故选C.
点评 本题考查物质的量浓度与质量分数的关系计算,题目难度中等,注意乙醇的密度小于水,乙醇溶液的浓度越大密度越小,注意中学常见浓度越大密度越小的溶液有氨水、酒精溶液等.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
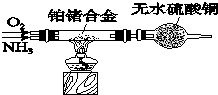 氮及其化合物在很多方面有重要的用途.
氮及其化合物在很多方面有重要的用途.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞变红色的溶液中:Na+、Fe3+、SO42-、Cl- | |
| B. | 饱和氯水中:K+、Na+、Cl-、HSO3- | |
| C. | 室温下,pH=13的溶液中:Na+、K+、SiO32-、Cl- | |
| D. | 1.0mol/L的KNO3溶液:H+、Fe2+、Cl-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | C(SO42- )为0.02mol/L | B. | 100mL溶液中含有0.01mol Al3+ | ||
| C. | 溶液中一定存在Na+ | D. | 无法确定是否含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com