
 (1)已知在常温下,常见弱酸和弱碱的电离平衡常数如下表所示:
(1)已知在常温下,常见弱酸和弱碱的电离平衡常数如下表所示:| 电解质 | HF | CH3COOH | HNO2 | NH3•H2O |
| 电离平衡常数K | 3.53×10-4 | 1.76×10-5 | 4.6×10-4 | 1.77×10-5 |
分析 (1)根据溶液的酸碱性以及利用盐类的水解程度来确定溶液中pH大小,酸的酸性越弱则酸的酸根离子水解程度越大,其相同浓度钠盐溶液的pH越大;
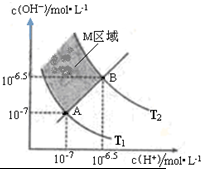
(2)A.任何水溶液中都存在c(H+)×c(OH-)=Kw;
B.温度不同氢离子的浓度不同pH不同;
C.水的电离是吸热反应,升高温度促进水电离,则Kw逐渐增大;
D.在AB连线的上方,c(H+)<c(OH-),在AB连线的下方,c(H+)>c(OH-).
解答 解:(1)水解呈碱性的有②CH3COONa ③NaNO2,酸的Ka越大,酸越强,对应盐水解程度越小,其PH越小,则pH:②>③;
水解呈酸性的有:⑤NH4Cl;
水解呈中性有:①CH3COONH4,醋酸和NH3•H2O的电离常数基本相当,所以CH3COONH4水解显中性;
酸有:④HF,
由于水解程度较小,所以水解产生的氢离子浓度小于电离产生的氢离子浓度;所以溶液pH值由小到大的顺序是④⑤①③②;
故答案为:④⑤①③②;
(2)A.只要是水溶液中,都会有c(H+)×c(OH-)=Kw,故A正确;
B.AB连线是一条Kw渐渐变大的线,pH也变大,故B错误;
C.水的电离是吸热反应,升高温度促进水电离,则Kw逐渐增大,B点Kw大于A点,所以T1<T2,故C正确;
D.AB连线的斜率是1,存在c(H+)=c(OH-),在AB连线的上方,c(H+)<c(OH-),在AB连线的下方,c(H+)>c(OH-),故D错误;
故答案为:AC.
点评 本题考查了溶液pH的大小比较、溶液中电荷守恒的应用、水解原理的应用、酸碱混合后溶液中的离子的浓度关系等,题目侧重于反应原理的应用,题目综合性较强,难度中等.


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:选择题
| A. | 醛荃的电子式: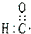 | B. | CH4分子的球棍模型: | ||
| C. | 乙烯的最简式(实验式):CH2 | D. | 苯乙醛结构简式: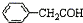 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 向100mlMgCl2 和 AlCl3的混合溶液,逐滴加入1mol/LNaOH溶液,如图:
向100mlMgCl2 和 AlCl3的混合溶液,逐滴加入1mol/LNaOH溶液,如图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
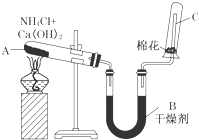 实验室中用如图所示装置制取干燥的氨气.
实验室中用如图所示装置制取干燥的氨气.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
图示 | 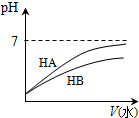 | 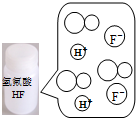 | 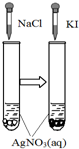 | 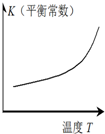 |
| 结论 | HB为弱酸 | HF为弱电解质 | 溶解度:AgI<AgCl | 正反应△H>0 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据HA、HB的电离常数的相对大小可以直接判断两种溶液的酸性强弱 | |
| B. | 常温下2S2O(g)=3S(s)+SO2(g)能自发进行,可推断该反应为放热反应 | |
| C. | 加入硫酸铜可使锌与稀硫酸的反应速率加快,说明Cu2+具有催化作用 | |
| D. | 将浓硫酸和浓硝酸混合后立即放入铁片,铁片被钝化的效果一定会更好 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①② | B. | 只有①③ | C. | 只有②③ | D. | 只有③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
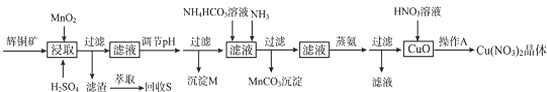
| 离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com