
| A. | 单晶硅制芯片 | B. | SiO2制光导纤维 | ||
| C. | 金刚砂(碳化硅)作砂轮的磨料 | D. | 水玻璃作黏合剂 |
 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:选择题
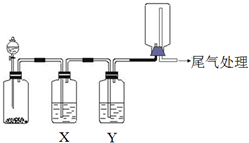
| 选项 | 实验目的 | X中试剂 | Y中 试剂 |
| A | 粗锌与稀盐酸制取 收集干燥的氢气 | 饱和食盐水 | 浓硫酸 |
| B | Na2SO3固体与较浓盐酸 反应制取收集干燥SO2 | 饱和Na2SO3溶液 | 浓硫酸 |
| C | 铜与稀硝酸制取并收集 纯净干燥的NO | 水 | 浓硫酸 |
| D | CaCO3和稀盐酸制取收集 纯净干燥的CO2 | 饱和NaHCO3溶液 | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某研究性学习小组设计了一组实验探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用图装置完成了O元素的非金属性比S强的实验研究.回答下列问题:
某研究性学习小组设计了一组实验探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用图装置完成了O元素的非金属性比S强的实验研究.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-+H2O?H3O++CO32- | B. | ClO-+H3O+?HClO+H2O | ||
| C. | HS-+H2O?H2S+OH- | D. | NH4++OH-?NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W |
| A. | W元素的非金属性比Z元素的非金属性弱 | |
| B. | Z和X能以共价键结合形成一种无机非金属材料 | |
| C. | Y元素的最高价氧化物的水化物是含氧酸中酸性最强的 | |
| D. | X的气态氢化物是同主族元素气态氢化物中最稳定的,原因是其分子间有氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
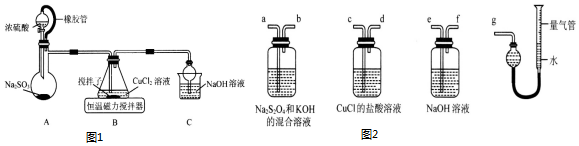
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 阳极的电极反应式:4OH--4e-═O2↑+2H2O | |
| B. | 若将阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,同样可制得纯净物的H3PO2 | |
| C. | H3PO2分子中P元素的化合价为+1价 | |
| D. | 阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO2-穿过阴膜扩散至产品室,二者反应生成H3PO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 25℃时,部分物质的电离平衡常数如表所示:
25℃时,部分物质的电离平衡常数如表所示:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com