
| A. |  表示不同温度下,水溶液中H+和OH-的浓度变化,温度a>b | |
| B. | 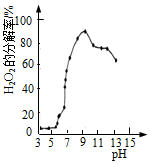 表示30%H2O2在60℃时分解率与pH关系,说明pH越大H2O2分解率越大 | |
| C. |  表示体积均为V0、pH均为3的盐酸和醋酸稀释时的pH变化,a表示盐酸 | |
| D. |  是等浓度NaCl和NaI溶液分别用AgNO3溶液滴定,则Ksp(AgI)>Ksp(AgCl) |
分析 A.水的离子积常数为Kw=c(H+)•c(OH-),水的电离过程是吸热反应,温度升高,有利于促进水的电离;
B.随着pH升高,H2O2的分解率并不是直线上升;
C.盐酸是强酸,溶液中的n(H+)保持不变,随着稀释进行,溶液中c(H+)下降很快;
D.当加入等体积的AgNO3溶液中,难溶性的沉淀中平衡时阴离子浓度更小.
解答 解:A.水的离子积常数为Kw=c(H+)•c(OH-),水的电离过程是吸热反应,温度升高,有利于促进水的电离,水的离子常数变大,根据图象分析,则温度b>a,故A错误;
B.根据图象分析,随着pH升高,H2O2的分解率并不是直线上升,在pH=9之后,甚至出现了下降,因此并不是纯粹的pH越大H2O2分解率越大,故B错误;
C.盐酸是强酸,溶液中的n(H+)保持不变,随着稀释进行,溶液中c(H+)下降很快,则pH值随着稀释上升的很快,根据图象,a表示盐酸,故C正确;
D.当加入等体积的AgNO3溶液中,难溶性的沉淀中平衡时阴离子浓度更小,根据图象分析,平衡时-lg(I-)>-lgc(Cl-),则c(I-)<c(Cl-),AgCl和AgI是同类型沉淀,所以Ksp(AgI)<Ksp(AgCl),故D错误.
故选C.
点评 本题考查了水的离子积常数,溶液的pH,沉淀溶解平衡,溶度积常数,考查的是综合运用化学知识的能力,均为高频考点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 天然气和沼气的主要成分是甲烷 | |
| B. | 等物质的量的乙醇和乙酸完全燃烧时所需氧气的质量相等 | |
| C. | 油脂和蛋白质在一定条件下都能水解 | |
| D. | 葡萄糖和蔗糖都含有C、H、O三种元素,但不是同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤和石油主要组成元素均为碳、氢元素,二者都是混合物 | |
| B. | 煤的干馏和石油的分馏原理相同,都是化学变化 | |
| C. | 煤的液化主要是为了得到苯等重要的有机化工原料 | |
| D. | 煤的气化是物理变化,目的是获取高效、清洁的燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稳定性:NH3>PH3>AsH3 | B. | 原子半径:N>P>As | ||
| C. | 酸性:HClO4>H2SO4>H3PO4 | D. | 碱性:NaOH>Mg(OH)2>Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 盐酸体积(mL) | 20 | 40 | 60 | 80 |
| 产生气体体积(mL) | 0 | 560 | 1680 | 2520 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯分子中每个碳原子的原子轨道都发生sp2杂化,形成夹角为120°的三个sp2杂化轨道 | |
| B. | 乙烷、乙烯、乙炔分子中,碳原子轨道杂化方式和苯相同的只有乙烯 | |
| C. | 苯分子中存在6个C-C σ键和6个C-H σ键 | |
| D. | 每个碳原子的一个sp2杂化轨道采用“肩并肩”的方式重叠,形成一个大π键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,体积均为50.00mL、浓度均为0.1000mol/L的NaCl、NaBr及NaI三种溶液,分别用0.1000mol/L的AgNO3溶液滴定,滴定曲线如图所示:
常温下,体积均为50.00mL、浓度均为0.1000mol/L的NaCl、NaBr及NaI三种溶液,分别用0.1000mol/L的AgNO3溶液滴定,滴定曲线如图所示:| A. | 三种溶液各取10 mL混合,然后滴定,沉淀先后顺序为Cl-、Br-、I- | |
| B. | 滴定Cl-时,可加人少量的KI作指示剂 | |
| C. | 当滴定AgNO3溶液至70.00mL时,溶液中c(I-)>c (Br-)>c(Cl-) | |
| D. | 滴定曲线①、②、③分别表示NaI溶液、NaBr溶液、NaCl溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com