
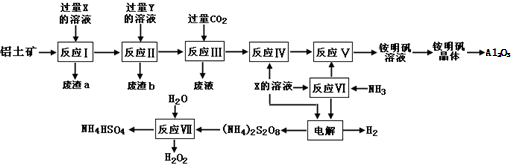
分析 铝土矿(主要成分为Al2O3和少量的 SiO2、Fe2O3杂质)铝土矿的主要成分是氧化铝,根据题中流程图可知,在反应Ⅲ中通入二氧化碳,而流程最后要得到硫酸盐,所以为了除去杂质,先在铝土矿中加入过量的稀硫酸,得废渣a为SiO2,滤液中含有Al3+、Fe3+,所以X为稀硫酸,再加过量的氢氧化钠溶液,生成偏铝酸钠溶液和氢氧化铁沉淀,所以废渣b为氢氧化铁,Y为氢氧化钠,反应Ⅲ为偏铝酸钠溶液与过量二氧化碳反应生成氢氧化铝沉淀和废液,反应Ⅳ为氢氧化铝中加上硫酸可以制得Al2(SO4)3,反应Ⅵ中氨气与硫酸反应生成(NH4)2SO4,反应Ⅴ中(NH4)2SO4转化为铵明矾,电解硫酸和硫酸铵的混合溶液,在阴极上得氢气,阳极上得(NH4)2S2O8,反应ⅤⅡ为(NH4)2S2O8与水反应生成双氧水和NH4HSO4,据此答题.
(1)由上述分析可知,废渣a为SiO2,母液不能蒸干的原因是减少可溶性杂质的析出及Al3+水解;
(2)反应ⅤⅡ为(NH4)2S2O8与水反应生成双氧水和NH4HSO4;
(3)根据题中数据,计算出铝元素质量、硫酸根离子质量,再根据总质量计算出水的质量,最后计算出铵明矾的化学式;
(4)依据电荷守恒可以计算另一种离子物质的量分析.(3)NH4Al(SO4)2•12H2O;
(5)根据电解原理阳极失电子发生氧化反应,SO42?失电子生成S2O82-,结合电荷守恒写出电极反应.
解答 解:(1)由上述分析可知,废渣a为SiO2,名称为二氧化硅,母液经蒸发浓缩至溶液表面刚出现薄层的结晶为止,冷却结晶,得到铵明矾(含结晶水).母液不能蒸干的原因是减少可溶性杂质的析出及Al3+水解,
故答案为:二氧化硅,减少可溶性杂质的析出及Al3+水解
(2)根据元素守恒和题中信息可知,反应ⅤⅡ为(NH4)2S2O8与水反应生成双氧水和NH4HSO4,反应Ⅶ的化学方程式为(NH4)2S2O8+2H2O=2NH4HSO4+H2O2,
故答案为:(NH4)2S2O8+2H2O=2NH4HSO4+H2O2
(3)a.称取90.6g铵明矾样品,高温灼烧,得Al2O3残留固体10.20g,氧化铝的物质的量为:$\frac{10.20g}{102g/mol}$=0.1mol,含有0.2mol铝离子,质量为5.4g
b.称取90.6g铵明矾样品,用适量蒸馏水溶解,再加入稍过量的BaCl2溶液,经陈化、过滤、灰化,得BaSO493.2g;硫酸钡的物质的量为:$\frac{93.2g}{233g/mol}$=0.4mol,含有硫酸根离子的物质的量为0.4mol,质量为38.4g,
c.称取90.6g样品,加入足量的NaOH溶液,加热,产生气体依次通过碱石灰和浓硫酸,浓硫酸增重3.40g,浓硫酸增重的质量为氨气质量,氨气的物质的量为:$\frac{3.40g}{17g/mol}$=0.2mol,铵离子的物质的量为0.2mol,质量为3.6g,
90.6g样品中,含有水的质量为:90.6g-5.4-38.4-3.6=43.2g,水的物质的量为:$\frac{43.2g}{18g/mol}$=2.4mol,
n(NH4+):n(Al3+):n(SO42-)):n(H2O)=0.2:0.2:0.4:2.4=1:1:2:12,
所以铵明矾的化学式:NH4Al(SO4)2•12H2O
故答案为:NH4Al(SO4)2•12H2O;
(7)第(3)问测定铵明矾组成的方法a、b、c三个试验中,有一个实验不必实施也能推导出铵明矾的化学式,合理,铵根离子和氯离子只需测定一种,按照电荷守恒计算另一种阳离子的物质的量,所以合理,填a或c,
故答案为:a或c;
(5)根据电解原理阳极失电子发生氧化反应,SO42?失电子生成S2O82-,电极方程式为2SO42--2e-═S2O82-,
故答案为:2SO42--2e-=S2O82-.
点评 本题考查制备实验方案的设计,为高频考点,侧重考查化学流程的分析、基本操作、电解原理、离子浓度比较、化学反应的判断,把握工艺流程及发生的反应、混合物分离提纯等为解答的关键,题目难度中等,需要学生具备阅读获取信息能力、综合运用知识、信息分析问题解决问题能力.


科目:高中化学 来源: 题型:选择题
| A. | [Co (NH3)6]Cl3 | B. | [Co (NH3)3Cl3] | C. | [Co (NH3)4Cl2]Cl | D. | [Co (NH3)5Cl]Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正常雨水的pH值是7 | |
| B. | 冶炼金属钠用热分解法 | |
| C. | 使用过的塑料可以随意丢弃 | |
| D. | 治理水污染可以用混凝法、中和法、沉淀法等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaHSO3溶液中加入NaHSO4溶液:HSO${\;}_{3}^{-}$+H+═H2O+SO2↑ | |
| B. | 铁溶于稀硝酸,溶液变黄:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| C. | Ba(OH)2与H2SO4两稀溶液混合:Ba2++2OH-+2H++SO${\;}_{4}^{2-}$═BaSO4↓+2H2O | |
| D. | AlCl3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH${\;}_{4}^{+}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 制备二氧化锰的装置如图,阳极以硫酸锰和硫酸混合液为电解液,阴极以稀硫酸为电解液,电解装置中箭头表示溶液中阳离子移动的方向.下列说法不正确的是( )
制备二氧化锰的装置如图,阳极以硫酸锰和硫酸混合液为电解液,阴极以稀硫酸为电解液,电解装置中箭头表示溶液中阳离子移动的方向.下列说法不正确的是( )| A. | N是电源的正极 | |
| B. | 右侧气孔逸出的气体可能为副产物O2 | |
| C. | 石墨电极反应为Mn2+-2e-+2H2O=MnO2+4H+ | |
| D. | 电解过程中阳离子交换膜左侧硫酸浓度基本不变,右侧减小. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| A(g) | B(g) | C(g) | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | 0.40 | ||
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
| A. | 该反应的正反应为放热反应 | |
| B. | 达到平衡时,容器Ⅰ中的A体积分数与容器Ⅱ中的相同 | |
| C. | 容器Ⅰ中反应到达平衡所需时间比容器Ⅲ中的短 | |
| D. | 若起始时向容器Ⅰ中充入0.15 mol A、0.15 mol B 和0.10 mol C则反应将向逆反应方向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
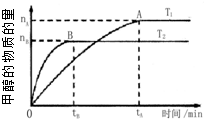 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l )的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.请回答下列问题:
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l )的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下在水中溶解性比KHCO3>K2CO3 | |
| B. | 热稳定性K2CO3<KHCO3 | |
| C. | 和酸反应放出CO2的快慢KHCO3>K2CO3 | |
| D. | 等量的盐酸分别与足量KHCO3和K2CO3反应,产生CO2一样多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com