
| A. | NaOH、KOH | B. | NaOH、Cu(OH)2 | C. | Fe(OH)2、Cu(OH)2 | D. | Fe(OH)2、Fe(OH)3 |
分析 100mL2mol/L的盐酸溶液中氯离子物质的量n=0.1L×2mol/L=0.2mol,结合氯元素守恒计算分析判断,
解答 解:A.NaOH、KOH物质的量分别为x、y,x+y=0.2mol,40x+56y=8,y=0,故A错误;
B.NaOH、Cu(OH)2 物质的量分别为x、y,x+2y=0.2mol,40x+98y=8,y=0,故B错误;
C.Fe(OH)2、Cu(OH)2物质的量分别为x、y,2x+2y=0.2mol,90x+98y=8,y<0,故C错误;
D.Fe(OH)2、Fe(OH)3物质的量分别为x、y,2x+3y=0.2mol,90x+107y=8,x=0.05,y=$\frac{1}{28}$,混合物组成可能是Fe(OH)2、Fe(OH)3,故D正确;
故选D.
点评 本题考查了混合物组成的分析计算,注意元素守恒的应用,掌握基础是解题关键,题目难度中等.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:实验题
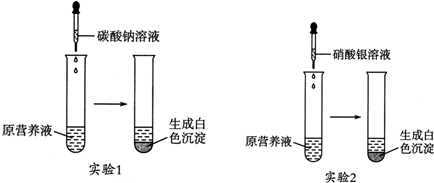
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10 m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高正化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| 最低负化合价 | -2 | -3 | -1 | -3 |
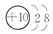 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X只能是第二周期的元素 | B. | a一定比b小 | ||
| C. | b-a+m+n一定等于16 | D. | Y只能是第三周期的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2项 | B. | 3项 | C. | 4项 | D. | 5项 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
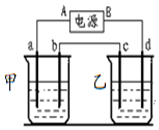 按如图的实验装置进行实验,其中a、b、c、d均为惰性电极.电解质溶液分别为硫酸铜和饱和氯化钠溶液,通电一段时间后,根据下列现象作出判断:【假设电解质均足量】
按如图的实验装置进行实验,其中a、b、c、d均为惰性电极.电解质溶液分别为硫酸铜和饱和氯化钠溶液,通电一段时间后,根据下列现象作出判断:【假设电解质均足量】查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com