
一定温度下,在容积固定的V L密闭容器里加入n mol A、2n mol B,发生反应:A(g)+2B(g) 2C(g) ΔH<0,反应达平衡后测得平衡常数为K,此时A的转化率为x。
2C(g) ΔH<0,反应达平衡后测得平衡常数为K,此时A的转化率为x。
(1)K和x的关系满足K=________。在保证A浓度不变的情况下,增大容器的体积,平衡________(填字母)。
A.向正反应方向移动
B.向逆反应方向移动
C.不移动
(2)若该反应的逆反应速率与时间的关系如图所示:

①可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的是什么条件:
t2时________________;
t8时________________;
②t2时平衡向________(填“正反应”或“逆反应”)方向移动;
③若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系线。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014年高考化学苏教版总复习 8-4 难溶电解质的溶解平衡练习卷(解析版) 题型:选择题
已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。下列关于难溶物之间转化的说法中错误的是( )
A.AgCl不溶于水,不能转化为AgI
B.两种难溶物的Ksp相差越大,难溶物就越容易转化为更难溶的物质
C.AgI比AgCl更难溶于水,所以AgCl可以转化为AgI
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于6.34×10-12mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-1 弱电解质的电离平衡练习卷(解析版) 题型:填空题
用实验确定某酸HA是弱电解质。甲、乙两同学的方案是:
甲:①称取一定质量的HA配制0.1 mol/L的HA溶液100 mL;②用pH试纸测出该溶液的pH,即能证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各100 mL;②分别取这两种溶液各10 mL,加水稀释至100 ml;③各取相同体积的两种稀释液装入两个试管中,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)甲方案中,说明HA是弱电解质的理由是测得溶液的pH________1(填“>”“<”或“=”),乙方案中,说明HA是弱电解质的现象是________(填序号)。
a.装盐酸的试管中放出H2的速率快
b.装HA溶液的试管中放出H2的速率快
c.两个试管中产生气体的速率一样快
(2)请你评价乙方案中难以实现之处和不妥之处________。
(3)请你再提出一个合理而比较容易进行的方案(药品可任用),请表述实验方案:________。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-3 化学平衡的移动练习卷(解析版) 题型:选择题
在一定温度下,将等量的气体分别通入起始体积相同的密闭容器Ⅰ(恒容)和Ⅱ(恒压)中,使其发生反应,t0时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量与时间的变化关系如图所示,则下列有关推断正确的是 ( )

A.该反应的化学方程式:3X+2Y 3Z
3Z
B.若两容器中均达到平衡后,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所用时间小于t0
C.若两容器中均达到平衡后,两容器中Z的物质的量分数相同,则Y为固态或液态
D.达平衡后,若对容器Ⅱ升高温度时其体积增大,说明Z发生的反应为吸热反应
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-3 化学平衡的移动练习卷(解析版) 题型:选择题
在恒温条件下,有甲、乙两容器,甲容器为体积不变的密闭容器,乙容器为一个带有理想活塞(即无质量、无摩擦力的刚性活塞)的体积可变的密闭容器,两容器起始状态完全相同,都充有C气体,若发生可逆反应C(g) A(g)+B(g),经一段时间后,甲、乙两容器反应都达到平衡。下列说法中正确的是( )
A(g)+B(g),经一段时间后,甲、乙两容器反应都达到平衡。下列说法中正确的是( )
A.平衡时C的转化率:乙>甲
B.平衡时C的体积分数:乙>甲
C.反应速率:乙>甲
D.平衡时A的物质的量:甲>乙
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-2 化学反应的方向和限度练习卷(解析版) 题型:选择题
放热反应CO(g)+H2O(g) CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol·L-1,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则 ( )
CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol·L-1,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则 ( )
A.K2和K1的单位均为 mol·L-1
B.K2>K1
C.c2(CO)=c2(H2O)
D.c1(CO)>c2(CO)
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-2 化学反应的方向和限度练习卷(解析版) 题型:选择题
对于反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s) ΔH=-444.3 kJ·mol-1,且熵减小,在常温常压下该反应能自发进行,对反应的方向起决定作用的是 ( )
A.焓变 B.温度 C.压强 D.熵变
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-1 化学反应速率练习卷(解析版) 题型:选择题
合成氨反应:N2(g)+3H2(g) 2NH3(g);ΔH=-92.4 kJ·mol-1,在反应过程中,正反应速率的变化如下图:
2NH3(g);ΔH=-92.4 kJ·mol-1,在反应过程中,正反应速率的变化如下图:
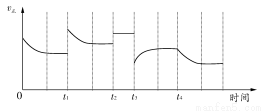
下列说法正确的是( )
A.t1时升高了温度 B.t2时使用了催化剂
C.t3时增大了压强 D.t4时降低了温度
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 6-1 化学反应中的热效应练习卷(解析版) 题型:选择题
红磷(P)和Cl2发生反应生成PCl3和PCl5,反应过程和能量的关系如下图所示,图中的ΔH表示生成1 mol产物的数据。已知PCl5分解生成PCl3和Cl2,该分解反应是可逆反应。下列说法正确的是( )
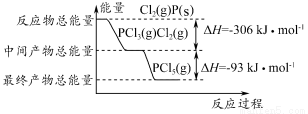
A.其他条件不变,升高温度有利于PCl5的生成
B.反应2P(s)+5Cl2(g)=2PCl5(g)对应的反应热 ΔH=-798 kJ·mol-1
C.P和Cl2反应生成PCl3的热化学方程式为2P(s)+3Cl2(g)=2PCl3(g) ΔH=-306 kJ·mol-1
D.其他条件不变,对于PCl5分解生成PCl3和Cl2的反应,增大压强,PCl5的转化率减小,平衡常数K不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com