
ClO2在常温下是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟用图1所示装置模拟工业制取并收集ClO2。
2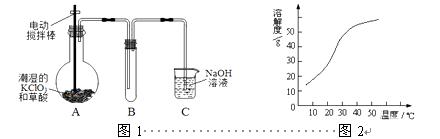
(1)A装置电动搅拌棒的作用是 。A装置必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有烧杯、 。
(2)B装置必须放在冰水浴中,其原因是 。
(3)反应后在装置C中可得NaClO2溶液。已知(1)NaClO2饱和溶液在温度低于38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2,温度高于60℃时NaClO2分解生成NaClO3和NaCl;(2)NaClO2的溶解度曲线如图2所示,请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:
①减压,55℃蒸发结晶;② ;③ ;④低于60℃干燥;得到成品。
(4)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100.00 mL试样;量取V1 mL试样加入到锥形瓶中;
步骤2:用稀硫酸调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入指示剂,用c mol·L-1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL(已知2 Na2S2O3 + I2 =Na2S4O6 + 2NaI)。
①配制100 mL c mol·L-1 Na2S2O3标准溶液时,用到的玻璃仪器除烧杯、量筒、玻璃棒外还有: 。
②滴定过程中进行三次平行测定的原因是 。
③若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果 。(填“偏高”、“偏低”或“不变” )
【知识点】溶液配制 滴定误差分析A3 H2
【答案解析】(1)反应时搅拌,增大反应物的接触面积,加快反应速率
温度计 (2) 使ClO2充分冷凝,减少挥发
(3)②趁热过滤 ③用38℃~60℃热水洗涤
(4)① 100 mL 容量瓶、胶头滴管 ②取平均值,减少计算误差 ③偏高 (每空2分)
解析:(1)A装置电动搅拌棒的作用是搅拌,增大反应物的接触面积,加快反应速率;要控制温度必须使用温度计测量温度,(2)二氧化氯的熔点较低,使ClO2充分冷凝,减少挥发,所以使用冰水浴;
(3)②从溶液中制取溶质,一般采用蒸发结晶、过滤、洗涤、干燥的方法,为防止析出晶体NaClO2•3H2O,应趁热过滤,③用38℃~60℃热水洗涤 ;
(4)① 配制100 mL c mol·L-1 Na2S2O3标准溶液时,用到的玻璃仪器除烧杯、量筒、玻璃棒外还有:100 mL 容量瓶、胶头滴管;②为减少实验误差,应采用多次实验的方法;③若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,读取Na2S2O3标准溶液的体积偏大,导致测定所得溶液中ClO2的含量偏高。
【思路点拨】本题考查了溶液配制,滴定误差分析等基本试验常识,比较基础。


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
汽车尾气(含烃类、CO、SO2与NO等有毒气体)是城市空气的污染源。治理方法之一是在汽车的排气管上装一个“催化转换器”(用Pt、Pd合金作催化剂),它的特点是使CO和NO反应,生成参与大气生态循环的无毒气体,并使汽油充分燃烧及SO2转化。
(1)写出NO和CO通过催化转换器发生反应的化学方程式_________
_______________________________________________________________。
(2)“催化转换器”的缺点是在一定程度上提高了空气的酸度,其原因是
________________________________________________________________。
(3)控制城市空气污染源的方法有 (填写字母序号)。
a.植树造林 b.开发氢能源 c.尾气达标排放 d.使用含铅汽油
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
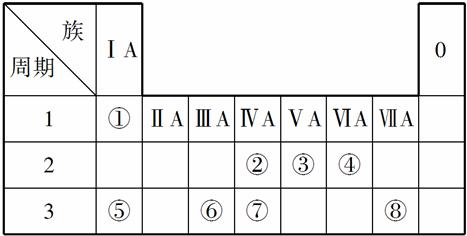
(1)④、⑤、⑥的原子半径由大到小的顺序为______________________。
(2)②、③、⑦三种元素的非金属性由强到弱的顺序是____________________。
(3)①、④、⑤、⑧中的三种元素可形成既含离子键又含共价键的化合物,写出其中一种化合物的电子式:__________________。
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
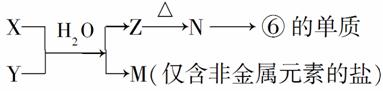
X溶液与Y溶液反应的离子方程式为______________________________,N→⑥的单质的化学方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
钢铁生锈过程发生如下反应:①2Fe+O2+2H2O===2Fe(OH)2;②4Fe(OH)2+O2+2H2O===4Fe(OH)3;③2Fe(OH)3===Fe2O3+3H2O。下列说法正确的是( )
A.反应①、②中电子转移数目相等
B.反应①中氧化剂是氧气和水
C.与铜质水龙头连接处的钢质水管不易发生腐蚀
D.钢铁在潮湿的空气中不能发生电化学腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)相同物质的量浓度、相同体积的NaCl、MgCl2、AlCl3溶液,分别与足量的AgNO3溶液反应,生成沉淀的质量之比为________。
(2)向等体积、等浓度的AgNO3溶液中,分别加入相同体积的NaCl、MgCl2、AlCl3溶液,恰好使它们中的Cl-完全转化为AgCl沉淀,则三种溶液的物质的量浓度之比为________。
(3)Na、Mg、Al分别与足量的硫酸溶液反应,当生成气体的质量相同时,消耗Na、Mg、Al的物质的量之比为________。
(4)足量的Al分别与等浓度的硫酸、氢氧化钠溶液反应,当生成气体的质量相同时,硫酸溶液和氢氧化钠溶液的体积比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用 NA示阿伏加德罗常数,下列叙述中正确的是()
A. 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02NA
B. 标准状况下,22.4LH2O 含有的水分子数为NA
C. 通常状况下,NA个CO2分子占有的体积为22.4L
D. 物质的量浓度为0.5mol/L的MgCl2溶液中含有Cl﹣个数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
已知氨气的化学式是NH3,其相对分子质量为,其摩尔质量为16.8g NH3的物质的量为0.4mol,其标准状况下的体积为,其含NH3分子的个数为,含有氢原子的个数为.
查看答案和解析>>
科目:高中化学 来源: 题型:
在100g浓度为18mol/L、密度为ρ(g/cm3)的浓硫酸中加入一定量的水稀释成9mol/L的硫酸,如果水的密度为1g/cm3则加入水的体积()
A. 小于100mL B. 等于100mL C. 大于100mL D. 不能确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com