
| A. | 16g/mol | B. | 32g/mol | C. | 64g/mol | D. | 128g/mol |
分析 相同状况下,一个空瓶,气体的体积相同,则气体的物质的量相同,结合n=$\frac{m}{M}$及摩尔质量与相对分子质量数值相等来解答.
解答 解:已知集气瓶的质量为20.0g,则氧气的质量为21.0g-20.0g=1g,
则n=$\frac{m}{M}$=$\frac{1g}{32g/mol}$=$\frac{1}{32}$mol,
气体的体积相同,则气体的物质的量相同,
所以A的摩尔质量为:M=$\frac{m}{n}$=$\frac{22g-20g}{\frac{1}{32}mol}$=64g/mol;
故选:C.
点评 本题考查物质的量的计算及阿伏加德罗定律,把握题意确定不同气体的体积相同,其物质的量相同为解答的关键,注重基础知识的考查,题目难度不大.


科目:高中化学 来源: 题型:填空题
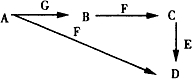 A~G为中学化学中常见的物质,B、E、F为单质,在常温下B是一种有色气体,G为黑色的固体.它们的相互转化如图所示,部分生成物未列出.试回答下列问题
A~G为中学化学中常见的物质,B、E、F为单质,在常温下B是一种有色气体,G为黑色的固体.它们的相互转化如图所示,部分生成物未列出.试回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:解答题
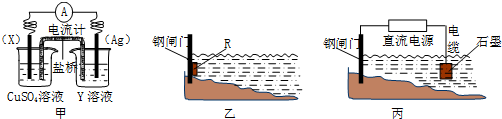
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质钠与水的反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 氢气在氯气中燃烧:H2+Cl2═2H++2Cl- | |
| C. | 小苏打治疗胃酸过多:H++HCO3-═H2O+CO2↑ | |
| D. | 用氯化铁溶液腐蚀铜箔制造印刷电路板:Fe3++Cu═Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、HCO3-、SO42-、Br- | B. | Cu2+、NO3-、Cl-、SO42- | ||
| C. | H+、Cl-、Na+、CO32- | D. | H+、Na+、S2-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 200mL 1mol•L-1 的NaCl溶液 | B. | 150mL 1mol•L-1 的MgCl2溶液 | ||
| C. | 100mL 1mol•L-1 的HCl溶液 | D. | 50mL 1mol•L-1 的AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物 质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 |
| 乙 醇 | -114 | 78 | 0.789 |
| 乙 酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.900 |
| 浓H2SO4 | 338 | 1.84 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com