
认真观察下列装置,回答下列问题:
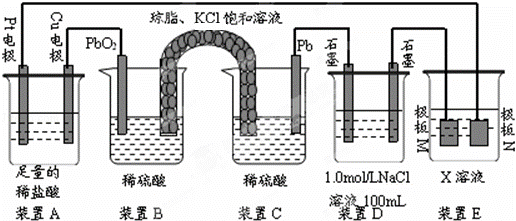
(1)装置B中PbO2上发生的电极反应方程式为 .
(2)装置A中总反应的离子方程式为 .
(3)若装置E中的目的是在Cu材料上镀银,则X为 ,极板N的材料为Ag.若装置E的目的是验证金属的电化学防腐,则极板N的材料为 .
(4)当装置A中Cu电极质量改变6.4g时,装置D中产生的气体体积为 L(标准状况下).
考点: 原电池和电解池的工作原理.
专题: 电化学专题.
分析: (1)B和C装置形成原电池,铅作负极,二氧化铅作正极,正极上二氧化铅得电子和硫酸根离子反应生成硫酸铅;
(2)A连接电源,则A是电解池,左边Pt作阴极,右边Cu作阳极,阳极上Cu放电,阴极上氢离子放电;
(3)电镀时,镀层作阳极,镀件作阴极,电解质溶液中阳离子和镀层金属相同;若装置E的目的是验证金属的电化学防腐,阳极用惰性电极;
(4)根据转移电子守恒计算生成气体的体积.
解答: 解:(1)B和C装置形成原电池,铅作负极,二氧化铅作正极,原电池放电时,正极上二氧化铅得电子和硫酸根离子反应生成硫酸铅,发生还原反应,电极反应式为:PbO2+2e﹣+4H++SO42﹣═PbSO4+2H2O,
故答案为:PbO2+2e﹣+4H++SO42﹣═PbSO4+2H2O;
(2)A连接电源,则A是电解池,左边Pt作阴极,右边Cu作阳极,阳极上Cu放电,阴极上氢离子放电,装置A中总反应的离子方程式为Cu+2H+ Cu2++H2↑,
Cu2++H2↑,
故答案为:Cu+2H+ Cu2++H2↑;
Cu2++H2↑;
(3)镀时,镀层作阳极,镀件作阴极,电解质溶液中阳离子和镀层金属相同,若装置D的目的是在某镀件上镀银,则X为硝酸银溶液,N作阳极,应该是银,若装置E的目的是验证金属的电化学防腐,则极板N的材料为惰性电极(或石墨等不溶性惰性材料),被保护的金属连接电源阴极,
故答案为:AgNO3; Ag;惰性电极(或石墨等不溶性惰性材料);
(4)当装置A中Cu电极质量改变6.4g时,n(Cu)=0.1mol,则转移0.2mol电子,装置D中n(NaCl)=0.1mol,
阳极首先发生2Cl﹣2e﹣=Cl2↑、其次发生4OH﹣4e﹣=2H2O+O2↑,则阳极首先生成0.05molCl2,其次生成0.025molO2,
阴极只发生2H++2e﹣=H2↑,生成0.1molH2,则总共生成0.175mol气体,体积为0.175mol×22.4L/mol=3.92L,
故答案为:3.92.
点评: 本题考查了原电池和电解池原理,为高频考点,侧重于学生的分析能力和计算能力的考查,明确离子放电顺序是解本题关键,难点是电极反应式的书写,难度中等.


科目:高中化学 来源: 题型:
在一个固定体积为2升的密闭容器中,充入2mol A和1mol B,发生如下反应:2A(g)+B(g)⇌3C(g)+D(s),2分钟反应达到平衡,此时C的浓度为1.2 mol/L.
(1)2分钟内用B表示的平均反应速度为 ;
(2)若容器温度升高,平衡时混合气体的平均相对摩尔质量减小,则正反应为: (填“吸热”或“放热”)反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是()
①标准状况下,6.02×1023个分子所占的体积约是22.4L
②0.5mol H2所占体积为11.2L
③标准状况下,1mol H2O的体积为22.4L
④常温常压下,28g CO与N2的混合气体所含的原子数为2NA
⑤各种气体的气体摩尔体积都约为22.4L•mol﹣1
⑥标准状况下,体积相同的气体的分子数相同.
A. ①③⑤ B. ④⑥ C. ③④⑥ D. ①④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
据报道,我国拥有完全自主产权的氢氧燃料电池车已在奥运会期间为运动员提供服务.某种氢氧燃料电池的电解液为KOH溶液.下列有关电池的叙述不正确的是()
A. 正极反应式为:O2+2H2O+4e﹣═4OH﹣
B. 工作一段时间后,电解液中的KOH的物质的量不变
C. 电解质溶液中的OH﹣向负极移动
D. 用该电池电解CuCl2溶液,产生2.24LCl2(标准状况)时,有0.1mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积相同的两密闭容器A和B中,保持温度为150℃,同时向A容器中加入a mol HI,向B容器中加入b mol HI (a>b),当反应2HI (g)⇌H2(g)+I2(g) 达到平衡后,下列说法正确的是()
A. 应开始达到平衡,所需时间tA>tB
B. 平衡时 C(I2)A=C(I2)B
C. 平衡时I2蒸气在混合气体中的体积分数:A>B
D. A与B中HI的平衡分解率相等.
查看答案和解析>>
科目:高中化学 来源: 题型:
传统合成氨工业需要采用高温、高压和催化剂.近来美国化学家使用新型铁系催化剂,在常温下合成了氨气.下列说法正确的是()
A. 新型合成氨方法是吸热反应
B. 新型合成氨方法可简化生产设备
C. 新型催化剂提高了N2和H2的转化率
D. 两种方法中该反应的化学平衡常数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是关于反应A2(g)+3B2(g)⇌2C(g)△H<0的平衡移动图形,影响平衡移动的原因是()
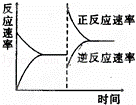
A. 升高温度,同时加压
B. 降低温度,同时减压
C. 增大反应物浓度,同时减小生成物浓度
D. 增大反应物浓度,同时使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿佛加德罗常数的值,下列说法不正确的是( )
|
| A. | 常温常压下,1mol氦气含有的原子数为NA |
|
| B. | 常温常压下,8g甲烷中含有的电子数为5NA |
|
| C. | 46gNO2和N2O4混合气体中含有的原子数为3NA |
|
| D. | 标准状况下,11.2L四氯化碳所含分子数 0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
含11.2g KOH的稀溶液与1L 0.1mol/L的H2SO4溶液反应放出11.46kJ的热量,下列能正确表示中和热的热化学方程式是()
A. KOH(aq)+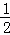 H2SO4(aq)=1/2K2SO4(aq)+H2O (l);△H=﹣11.46kJ/mol
H2SO4(aq)=1/2K2SO4(aq)+H2O (l);△H=﹣11.46kJ/mol
B. 2KOH(s)+H2SO4(aq)=K2SO4(aq)+2H2O (l);△H=﹣114.6kJ/mol
C. 2KOH(aq)+H2SO4=K2SO4(aq)+H2O (l);△H=+114.6kJ/mol
D. KOH (aq)+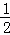 H2SO4(aq)=
H2SO4(aq)=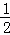 K2SO4(aq)+H2O (l);△H=﹣57.3kJ/mol
K2SO4(aq)+H2O (l);△H=﹣57.3kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com