
某实验需要80mL、1mol/L的Na2CO3溶液,现通过如下操作配制:
①称量10.6g Na2CO3固体放入小烧杯中,加适量蒸馏水溶解.为加快溶解可以使用玻璃棒玻璃棒搅拌;
②待溶液冷却到室温后,小心转入 (填仪器名称);
③继续加蒸馏水至液面至刻度线1~2cm处,改用 (填仪器名称)小心滴加蒸馏水至溶液凹液面最低点与刻度线相切;
④将容量瓶塞紧,充分摇匀;
⑤用少量蒸馏水洗涤玻璃棒和烧杯2~3次,每次洗涤的溶液都转入容量瓶,并轻轻摇匀.
(1)操作步骤正确的顺序是 (填序号).
(2)使用容量瓶前必须进行的一项操作是查漏
(3)若所配溶液的密度为1.06g/mL,则该溶液的质量分数为 .
(4)若取出20mL配好Na2CO3的溶液,加蒸馏水稀释成c(Na+)=0.1mol/L的溶液,则稀释后溶液的体积为 mL
(5)在配制Na2CO3溶液时,下列操作中的 会导致结果偏低
①用拖盘天平称量时砝码放在左盘
②将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外
③定容时俯视刻度线
④未冷却到室温就转移到容量瓶中
⑤干净的容量瓶未经干燥就用于配制溶液
⑥所用Na2CO3固体带部分结晶水.
考点: 配制一定物质的量浓度的溶液.
分析: (1)根据配制溶液的实验操作过程进行实验步骤排序,并完成步骤中填空;
(2)定容后需颠倒摇匀,使用容量瓶前必须进行检查容量瓶是否漏水;
(3)根据c=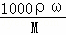 计算碳酸钠溶液的质量分数;
计算碳酸钠溶液的质量分数;
(4)根据钠离子守恒可知所配溶液c(Na+)=2c(Na2CO3),再根据稀释定律,稀释前后溶质的物质的量不变,来计算稀释后碳酸钠溶液的体积;
(5)分析操作对溶质的物质的量或对溶液的体积的影响,根据c=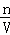 分析判断.
分析判断.
解答: 解:没有80mL的容量瓶,所以应选择100mL容量瓶.即所配溶液体积为100mL,
所以需Na2CO3的质量为m=0.1L×1mol•L﹣1×106g/mol=10.6g.
(1)操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解.冷却后转移到100mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2﹣3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以需要的仪器有天平、烧杯、玻璃棒、100mL容量瓶、胶头滴管、药匙.
正确的操作顺序是①②⑤③④.
故答案为:10.6 g;玻璃棒;100ml容量瓶; 胶头滴管;(1)①②⑤③④;
(2)定容后需颠倒摇匀,使用容量瓶前必须进行检查容量瓶是否漏水,故答案为:查漏;
(3)根据c=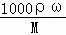 可知,碳酸钠溶液的质量分数ω=
可知,碳酸钠溶液的质量分数ω=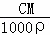 =
=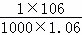 =10%,故答案为:10%;
=10%,故答案为:10%;
(4)所配溶液c(Na+)=2c(Na2CO3)=2×1mol•L﹣1=2mol•L﹣1,
根据稀释定律,稀释前后溶质的物质的量不变,来计算稀释后碳酸钠溶液的体积.
设稀释后碳酸钠溶液的体积为xmL,所以20mL×2mol/L=xmL×0.1mol/L,解得:x=400,所以稀释后碳酸钠溶液的体积是400mL.
故答案为:400mL;
(5)①用拖盘天平称量时砝码放在左盘时,m物=m砝﹣m游,则药品的质量偏小,故所配溶液的浓度偏低,故①选;
②将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外,会导致溶质的损失,则浓度偏低,故②选;
③定容时俯视刻度线,则体积偏小,则浓度偏高,故③不选;
④未冷却到室温就转移到容量瓶中,则冷却后溶液体积偏小,则浓度偏高,故④不选;
⑤若容量瓶未干燥即用来配制溶液,对溶液浓度无影响,因为只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响,故⑤不选;
⑥所用Na2CO3固体带部分结晶水,则Na2CO3的质量偏小,则浓度偏低,故⑥选.
故选①②⑥.
点评: 本题考查溶液的配制,难度不大,关键清楚溶液配制的原理,通过c=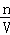 可以加深理解,注意碳酸钠称量应放在小烧杯中,托盘天平的精确度为0.1.
可以加深理解,注意碳酸钠称量应放在小烧杯中,托盘天平的精确度为0.1.


科目:高中化学 来源: 题型:
下列反应中,不属于氧化还原反应的是()
A. 3Cl2+6KOH=5KCl+KClO3+3H2O
B. 2NO2+2NaOH=NaNO3+NaNO2+H2O
C. CaO+H2O=Ca(OH)2
D. 2Na2O2+2H2O=4NaOH+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
关于胶体的下列叙述中正确的是()
A. 胶体和溶液、浊液的本质区别是胶体有丁达尔效应
B. 实验室制取氢氧化铁胶体的反应是复分解反应
C. 浊液中的粒子不能透过半透膜,胶体和溶液中的粒子则能透过
D. 胶体都是无色透明的液体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列四类反应:①置换反应 ②复分解反应 ③没有单质参加的化合反应 ④只有一种元素化合价发生变化的反应 ⑤离子反应,其中一定不是氧化还原反应的是()
A. 只有② B. 只有②③ C. 只有③④ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
已知氧化性强弱顺序:Cl2>Br2>Fe3+>I2.下列反应或叙述不正确的是()
A. Br2+2HI=I2+2HBr
B. 2FeCl2+Cl2=2FeCl3
C. 2FeCl2+2HCl+I2=2FeCl3+2HI
D. 少量Cl2通入到NaBr和NaI的混合溶液中,Cl2优先氧化I﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素W、X、Y、Z的原子序数依次增大,其中W的阴离子的核外电子数与X、Y、Z原子的核外内层电子数相同.X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质,而Z不能形成双原子分子.根据以上叙述,下列说法中正确的是( )
|
| A. | 上述四种元素的原子半径大小为W<X<Y<Z |
|
| B. | W、X、Y、Z原子的核外最外层电子数的总和为20 |
|
| C. | W与Y可形成既含极性共价键又含非极性共价键的化合物 |
|
| D. | 由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com