
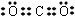 ;
;分析 Y的单质在W2中燃烧的产物可使品红溶液褪色,该产物为SO2,则Y为S元素,W为O元素,Z的单质在W中燃烧生成的化合物Z3W4具有磁性,则Z3W4为Fe3O4,Z为Fe元素,U的单质在W2中燃烧可生成UW和UW2两种气体,U原子序数小于O元素,应为CO和CO2气体,U为C元素,X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体,应为Mg和CO2的反应,则X为Mg元素,V的原子序数介于碳、氧之间,则V为N元素,据此解答.
解答 解:Y的单质在W2中燃烧的产物可使品红溶液褪色,该气体为SO2,则Y为S元素,W为O元素,Z的单质在W中燃烧生成的化合物Z3W4具有磁性,则Z3W4为Fe3O4,Z为Fe元素,U的单质在W2中燃烧可生成UW和UW2两种气体,U原子序数小于O元素,应为CO和CO2气体,U为C元素,X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体,应为Mg和CO2的反应,则X为Mg元素,V的原子序数介于碳、氧之间,则V为N元素.
(1)X为Mg元素,处于周期表中第三周期ⅡA族,UW2为CO2,电子式为 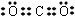 ,
,
故答案为:第三周期ⅡA族;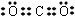 ;
;
(2)Fe单质与水蒸气反应生成四氧化三铁与氢气,化学方程式为:3Fe+4 H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2↑,故答案为:3Fe+4 H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2↑;
(3)U、V、W形成的10电子氢化物分别是CH4、NH3、H2O,非金属性C<N<O,故氢化物稳定性:H2O>NH3>CH4,NH3与H2O间能形成氢键,是氨气极易溶于水的主要原因,原电池负极发生氧化反应,氨气在负极失去电子,进行条件下生成氮气与水,负极电极反应式为:2NH3-6e-+6OH-=N2+6H2O,
故答案为:H2O>NH3>CH4;NH3与H2O间能形成氢键;2NH3-6e-+6OH-=N2+6H2O.
点评 本题考查元素化合物推断,需要学生熟练掌握元素化合物性质,关键是正确推断元素,需要学生具备扎实的基础,难度中等.


科目:高中化学 来源: 题型:实验题
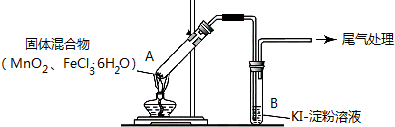
| 操作 | 现象 |
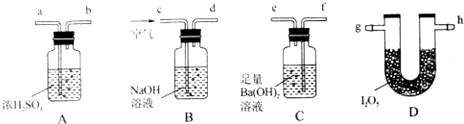
| 点燃酒精灯,加热 | i.A中部分固体溶解,上方出现白雾 ii.稍后,产生黄色气体,管壁附着黄色液滴 iii.B中溶液变蓝 |
| 方案1 | 在A、B间增加盛有某种试剂的洗气瓶C | B中溶液变为蓝色 |
| 方案2 | 将B中KI淀粉溶液替换为NaBr溶液;检验 Fe2+ | B中溶液呈浅橙红色;未检出Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,用pH计测量0.1mol•L-1FeCl3溶液的pH为a,再测量稀释10倍的0.01mol•L-1FeCl3溶液的pH为b,可判断出FeCl3水解程度与盐溶液浓度大小关系 | |
| B. | 将装有3~4mL无水乙醇的试管浸入50℃左右的热水中,将烧黑的铜丝迅速插入无水乙醇中,可观察到铜丝变红,反复数次,可闻到刺激性气味 | |
| C. | 向某溶液加浓NaOH溶液并微热,若产生的气体能使湿润的红色石蕊试纸变蓝,则说明此溶质为铵盐 | |
| D. | 酸碱中和滴定到终点读数时,发现滴定管尖嘴处悬挂一滴标准溶液,导致实验结果偏高 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式为CH2CH2 | B. | 羟基的电子式: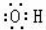 | ||
| C. | Ca2+的结构示意图为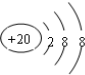 | D. | 乙醇的分子式:CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2可以漂白纸浆和草帽辫 | |
| B. | 单质硅可用做半导体材料 | |
| C. | 小苏打可作食品的膨松剂 | |
| D. | 合成纤维和光导纤维都是新型无机非金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
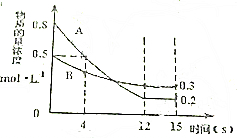 已知:反应aA(g)+bB(g)?cC(g)某温度下,在2L的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示.
已知:反应aA(g)+bB(g)?cC(g)某温度下,在2L的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,0.5mo1•L-1Fe2(SO4)3溶液中含Fe3+数目为1NA | |
| B. | 标准状况下,22.4L苯中含C-H数目为6NA | |
| C. | 常温常压下,16gO2和O3混合气体中,含氧原子的总数为1NA | |
| D. | 5.6gFe与足量稀盐酸反应,转移电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高一上第一次月考化学卷(解析版) 题型:选择题
下列实验方案设计中,可行的是
A.将O2和H2的混合气体通过灼热的氧化铜,以除去其中的H2
B.用萃取的方法分离汽油和水
C.用溶解和过滤的方法分离硝酸银和氯化钠固体混合物
D.加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铁粉
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com