
| A、甲=丙>乙 |
| B、丙>乙>甲 |
| C、乙>丙>甲 |
| D、甲=乙=丙 |


科目:高中化学 来源: 题型:
| A、非金属元素呈现的最高正化合价数值上不超过该元素原子的最外层电子数 |
| B、非金属元素呈现的最低负化合价,其绝对值等于该元素原子的最外层电子数 |
| C、最外层有2个电子的原子都是金属原子 |
| D、最外层有5个电子的原子都是非金属原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| A2B溶液的体积(mL) | 60 | 60 | 60 | 60 | 60 | 60 | 60 |
| CD2溶液的体积(mL) | 0 | 20 | 40 | 60 | 70 | 80 | 120 |
| 沉淀质量(g) | 0 | 0.464 | 1.395 | 1.404 | 1.397 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(H+)=1.0×10-13mol/L的溶液中:K+、Na+、CH3COO-、Br- |
| B、使石蕊试纸呈红色的溶液:Na+、AlO2-、SO42-、Br- |
| C、使甲基橙变红的溶液:MnO4-、NO3-、Na+、I- |
| D、与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、BaSO4、BaCO3都难溶于水,在医学上均可用作“钡餐” |
| B、用浸泡过高锰酸钾溶液的硅藻土保护水源 |
| C、明矾水解时产生具有吸附性的胶体粒子,可用作漂白粉 |
| D、棉花、蛋白质和油脂都是高分子化合物,水解产物均为电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | E | |
| A | ↓ | ||||
| B | ↑ | ↓ | |||
| C | ↑ | ↓↑ | ↓ | ||
| D | ↓ | ↑↓ | ↓ | ||
| E | ↓ | ↓ | ↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
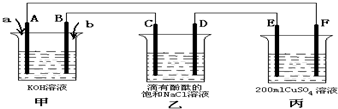
查看答案和解析>>
科目:高中化学 来源: 题型:
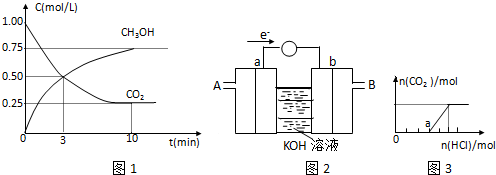
| n(CH3OH) |
| n(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com