
(07年上海卷)一定量的氢气在氯气中燃烧,所得混合物用100mL 3.00mol/L的NaOH溶液(密度为1.12g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500mol。
(1)原NaOH溶液的质量分数为
(2)所得溶液中Cl-的物质的量为 mol
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)= 。
答案:(1)10.7%
(2)0.25
(3)32
解析:此题考查的是氢气和氯气的反应,以及氯气和NaOH的反应。
解:(1)n(NaOH)=0.1L×3.00mol/L
=0.3mol
w(NaOH)=0.3mol×40g/mol÷(100ml×1.12g/mL) ×100%
≈10.7%
(2)由钠守恒可知,溶液中
n(NaOH)=n(NaCl) +n(NaClO)
n(Cl-)=0.3mol-0.0500mol
=0.25mol
(3)Cl2+H2=2HCl Cl2+2NaOH= NaCl+ NaClO+H2O
由反应方程式可知:与NaOH反应的氯气为0.05mol,该反应生成的NaCl为0.05mol,因此氢气燃烧产生氯化氢为0.20mol,则氢气为0.1mol.总的氯气为0.15mol。所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)=32


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
(07年上海卷)请你运用所学的化学知识判断,下列有关化学观念的叙述错误的是()
A . 几千万年前地球上一条恐龙体内的某个原子可能在你的身体里
B. 用斧头将木块一劈为二,在这个过程中个别原子恰好分成更小微粒
C . 一定条件下,金属钠可以成为绝缘体
D. 一定条件下,水在20℃时能凝固成固体
查看答案和解析>>
科目:高中化学 来源: 题型:
(07年上海卷)下列有关化学键与晶体结构说法正确的是()
A.两种元素组成的分子中一定只有极性键
B.离子化合物的熔点一定比共价化合物的高
C .非金属元素组成的化合物一定是共价化合物
D. 含有阴离子的化合物一定含有阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
(07年上海卷)今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是()
A. K+一定存在 B.100mL溶液中含0.01mol CO32-
C. Cl-可能存在 D.Ba2+一定不存在,Mg2+可能存在
查看答案和解析>>
科目:高中化学 来源: 题型:
(07年上海卷)现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | M层上有2对成对电子 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
(1)元素T的原子最外层共有 ___ 种不同运动状态的电子。元素X的一种同位素可测定文物年代,这种同位素的符号是____ 。
(2)元素Y与氢元素形成一种离子 YH4+ ,写出该微粒的电子式 ___ (用元素符号表示)
(3)元素Z与元素T相比,非金属性较强的是____ (用元素符号表示),下列表述中能证明这一事实的是:
a 常温下Z的单质和T的单质状态不同
b Z的氢化物比T的氢化物稳定
c 一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是______ ,理由是 _______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
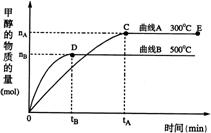 (07年上海卷)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)
(07年上海卷)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) ![]() CH3OH(g)
CH3OH(g)
根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K=
,升高温度,K值 (填“增大”、“减小”或“不变”)。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
a 氢气的浓度减少 b 正反应速率加快,逆反应速率也加快
c 甲醇的物质的量增加 d 重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是: (用化学方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com