
| A.c(H+)·c(OH-)比值不变 | B.溶液pH增大 |
| C.c(OH-)降低了 | D.水电离出的c(H+)增加了 |
科目:高中化学 来源:不详 题型:填空题
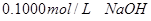 分别滴定
分别滴定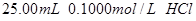 和
和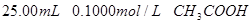 ,滴定过程中
,滴定过程中 变化曲线如下图所示。
变化曲线如下图所示。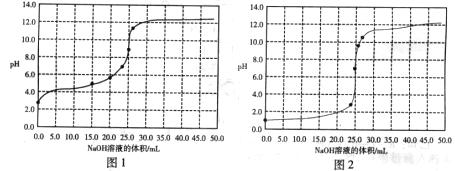
 变化曲线为 (填“图1”或“图2”),判断的理由是
变化曲线为 (填“图1”或“图2”),判断的理由是 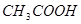 溶液的过程中,
溶液的过程中,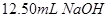 后,溶液中离子浓度由大到小的顺序为 .
后,溶液中离子浓度由大到小的顺序为 . 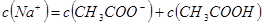 时,溶液
时,溶液 7(填“>”、“=”或“<”)。
7(填“>”、“=”或“<”)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.pH=1的溶液中:Fe 、NO 、NO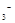 、SO 、SO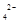 、Na 、Na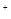 |
B.由水电离的c(H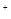 ) )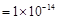 mol/L的溶液中:Ca mol/L的溶液中:Ca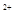 、K 、K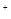 、Cl 、Cl 、HCO 、HCO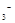 |
C.c(H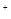 )/c(OH )/c(OH ) ) 的溶液中:NH 的溶液中:NH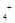 、Al 、Al 、NO 、NO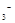 、Cl 、Cl |
D.c(Fe ) )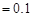 mol/L的溶液中:K mol/L的溶液中:K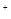 、ClO 、ClO 、SO 、SO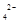 、SCN 、SCN |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
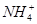 )由大到小的顺序是
)由大到小的顺序是  H++A2-
H++A2-查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H++HA-,HA-
H++HA-,HA- H++A2-。
H++A2-。 Ca2+(aq)+A2-(aq) △H>0。
Ca2+(aq)+A2-(aq) △H>0。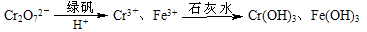
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A. c(H+)/c(OH-)=1012的溶液中:NH4+、K+、HCO3-、NO3- |
| B. c(OH-)=0.1mol/L的溶液中:CO32-、Cl-、F-、K+ |
| C.含大量Al3+的溶液中: K+、Na+、SO32-、ClO- |
| D.甲基橙呈黄色的溶液中:I-、Cl-、NO3-、Na+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
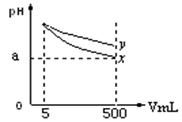
| A.相同温度下,x的电离平衡常数小于y |
| B.若x、y是一元碱,等物质的量浓度的盐酸盐溶液,y的pH大 |
| C.若x、y都是弱碱,则a的值一定大于9 |
| D.完全中和x,y两溶液时,消耗同浓度稀硫酸的体积V(x)>V(y) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Cl-、SO42-、Na+、K+ | B.K+、Cu2+-、Na+、NO3- |
| C.HCO3-、Na+、NO3-、K+ | D.NO3-、Ba2+、Cl-、NH4+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H++HA-,HA
H++HA-,HA H++A2-。回答以下问题:
H++A2-。回答以下问题: Ca2+(aq)+A2-(aq);ΔH>0。
Ca2+(aq)+A2-(aq);ΔH>0。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com