
【题目】实验室用下面装置测定FeO和Fe2O3固体混合物中Fe2O3的质量,D装置的硬质双通玻璃管中的固体物质是FeO和Fe2O3的混合物。

(1)为了安全,在点燃D处的酒精灯之前,在b处必须__________。
(2)装置B的作用是_______________ ,装置C中装的液体是________________。
(3)在气密性完好,并且进行了必要的安全操作后,点燃D处的酒精灯,在硬质双通玻璃管中发生的化学反应方程式是_____________________。
(4)若FeO和Fe2O3固体混合物的质量为23. 2g,反应完全后,U型管的质量增加7.2g则混合物中Fe2O3的质量为______________。
(5)U型管E右边连接干燥管F的目的是______________________,若无干燥管F,测得Fe2O3的质量将_____________(填“偏大”、“偏小”或“无影响”)
【答案】 验纯 除HCl 浓H2SO4 Fe2O3+3H2=2Fe+3H2O FeO+H2=Fe+H2O 16g 防止空气中水蒸气进入 偏大
【解析】(1)氢气是可燃性气体,装置中需要充满氢气后方可进行加热反应,所以需要对氢气进行验纯,避免混有空气加热发生爆炸,在b处必须收集氢气验纯;(2)由于A中产生的H2中混有HCl和水蒸气,必须通过洗气和干燥逐一除去,防止干扰后续实验,所以B的作用是除去氢气中的氯化氢,装置C中装的液体是浓硫酸,用于干燥氢气;(3)在硬质双通玻璃管中FeO和Fe2O3与氢气发生氧化还原反应生成铁和水,反应的化学反应方程式分别是:Fe2O3+3H2=2Fe+3H2O、FeO+H2=Fe+H2O;(4)U型管的质量增加的7.2g是水,物质的量是![]() mol=0.4mol,设FeO、Fe2O3物质的量分别为x、y,则:x+3y=0.4,根据质量可列式:72x+160y=23.2g,解得x=0.1,y=0.1, 所以氧化铁的质量为:160g/mol×0.1mol=16g;(5)U型管E右边连接干燥管F的目的是防止空气中水蒸气进入对实验干扰,若无干燥管F,空气中的水蒸气被E吸收则所测生成水的质量增大,导致氧的含量增大,测得Fe2O3的质量将将偏大。
mol=0.4mol,设FeO、Fe2O3物质的量分别为x、y,则:x+3y=0.4,根据质量可列式:72x+160y=23.2g,解得x=0.1,y=0.1, 所以氧化铁的质量为:160g/mol×0.1mol=16g;(5)U型管E右边连接干燥管F的目的是防止空气中水蒸气进入对实验干扰,若无干燥管F,空气中的水蒸气被E吸收则所测生成水的质量增大,导致氧的含量增大,测得Fe2O3的质量将将偏大。


科目:高中化学 来源: 题型:
【题目】在人体所需的十多种微量元素中,有一种称为“生命元素”的R元素。已知R元素的原子有四个电子层,其最高价氧化物分子式为RO3,则R元素的名称为
A. 硫 B. 砷 C. 硒 D. 硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列烯烃和H2O发生加成反应所得产物有同分异构体的是( )
A. CH3CH=CH2 B. CH3CH=CHCH3
C. CH2=CH2 D. (CH3)2C=C(CH3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下图点滴板上进行四个溶液间反应的小实验,其对应反应的离子方程式书写正确的是( )

A. a反应:Fe2++2H++H2O2===Fe3++2H2O
B. b反应:HCO![]() +OH-===CO
+OH-===CO![]() +H2O
+H2O
C. c反应:H++OH-===H2O
D. d反应:Al3++3NH3·H2O===Al(OH)3↓+3NH![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据图判断,下列说法正确的是
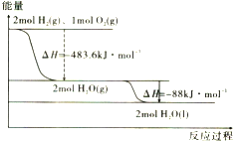
A. 2H2(g)+O2(g)=2H2O(g) △H1>0
B. 氢气的燃烧热为△H2= -241. 8kJ/mol
C. 上述A、B选项中的△H1>△H2
D. 液态水分解的热化学方程式为2H2O(l)= 2H2(g)+O2(g) △H=+571.6kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲酸铝广泛用于化工、石油等生产上,120150℃左右分解。在0℃时,溶解度为16g,100℃时,溶解度为18.4g。
首先用废铝渣制取AI(OH)3固体,流程如下:
![]()
(1)调节pH用_________试剂为好。某同学在减压过滤时,布氏漏斗内没有得到产品,可能原因是______________________。
然后将氢氧化铝和甲醛依次加入到质量分数为50%的过氧化氢溶液中(投料物质的量之比依次为1∶3∶2),装置如图1.最终可得到含甲酸铝90%以上的优质产品。反应式为:2Al(OH)3+6HCHO+3H2O2=2Al(HCOO)3+6H2O+3H2↑。
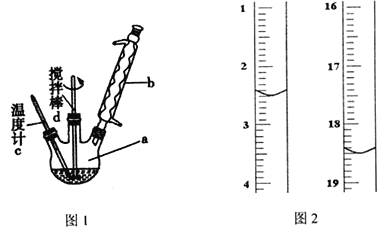
(2)反应过程可看作两步进行,第一步______________(写出化学方程式),第二步为甲酸与Al(OH)3 反应生成甲酸铝。
(3)反应温度最好控制在30—70℃之间,温度不宜过高,主要原因是_________________。
(4)实验时需强力搅拌45 min,最后将溶液____________,抽滤,洗涤,干燥得产品。可用酸性KmnO4标准溶液滴定法来测定产品纯度,滴定起始和终点的滴定管液面位置见上图2, 则消耗的酸性KmnO4标准溶液体积为__________________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3溶液与KSCN溶液混合时存在下列平衡:Fe3+(aq)+SCN-( aq) ![]() Fe(SCN)2+(aq) 已知某一条件下,反应达到平衡时,Fe(SCN)2+的物质的量浓度与温度的关系如图所示,下列说法正确的是
Fe(SCN)2+(aq) 已知某一条件下,反应达到平衡时,Fe(SCN)2+的物质的量浓度与温度的关系如图所示,下列说法正确的是
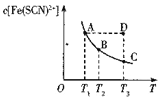
A.该反应为吸热反应
B.T1、T2时反应的平衡常数分别为K1、K2,则K1>K2
C.反应处于D点时,一定有v正大于v逆
D.A点的c(Fe3+)比B点的c(Fe3+)大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列实验事实:
①Cr2O3固体既能溶于KOH溶液得到KCrO2溶液,又能溶于硫酸得到Cr2(SO4)3溶液
②向KCrO2溶液中滴加H2O2溶液,再酸化,可得K2Cr2O7溶液
③将K2Cr2O7溶液滴加到淀粉和KI的混合溶液中,溶液变蓝。
下列判断不正确的是( )
A. 化合物KCrO2中Cr的化合价为+3
B. 实验①证明Cr2O3是两性氧化物
C. 实验②证明H2O2既有氧化性又有还原性
D. 实验③证明氧化性:Cr2O![]() >I2
>I2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com