
【题目】25 ℃时,下列说法正确的是
A. pH=12的NaOH溶液中,c(H+)=10-12 mol·L-1,将溶液稀释为原体积的10倍后c(H+)=![]() mol·L-1=10-13 mol·L-1
mol·L-1=10-13 mol·L-1
B. pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后,因生成的CH3COONa水解,所以由水电离出的 c(H+)>10-7 mol·L-1
C. pH=2的盐酸、pH=2的醋酸中由水电离出的c(H+)均为10-12 mol·L-1
D. pH=11和pH=13的NaOH溶液等体积混合后,溶液中的c(H+)=![]() mol·L-1
mol·L-1
【答案】C
【解析】
A、NaOH溶液中的H+是由水电离产生的,当稀释时,由于NaOH溶液的浓度发生变化,对H2O电离的抑制程度会改变,水的电离平衡会发生移动,因而将其当成不变的值进行计算是错误的,故A错误;B、CH3COOH电离出的H+即可将NaOH完全中和,而绝大多数的CH3COOH是没电离的,即CH3COOH远远过量,混合溶液呈酸性,对水的电离起抑制作用,故B错误;C、pH=2的盐酸、pH=2的醋酸中c(H+)均为10-2 mol·L-1,再结合水的离子积常数可求出 c(OH-)均为10-12 mol·L-1,由水电离出的c(H+)也均为10-12 mol·L-1,故C正确;D、pH=11的NaOH溶液中c(OH-)=10-3 mol·L-1,pH=13的NaOH溶液中c(OH-)=10-1 mol·L-1,等体积混合后c(OH-)=![]() ≈5×10-2 mol·L-1,再结合离子积常数求得c(H+)=2×10-13 mol·L-1,故D错误。
≈5×10-2 mol·L-1,再结合离子积常数求得c(H+)=2×10-13 mol·L-1,故D错误。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A. 1 molAl3+含有的核外电子数为3NA
B. 1 L 1 mol·L-1醋酸溶液中CH3COO-的数目小于NA
C. 7.8g苯中含有的碳碳双键数为0.3NA
D. 标准状况下,2.24L CCl4中的原子总数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向5 mL NaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变成黑色,根据上述变化过程,分析此三种沉淀物的溶解度关系为
A. AgCl=AgI=Ag2S B. AgCl<AgI<Ag2S
C. AgCl>AgI>Ag2S D. AgI>AgCl>Ag2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】21世纪是海洋开发与利用的世纪。海水资源的开发利用具有十分广阔的前景。海水开发利用的流程图如下:
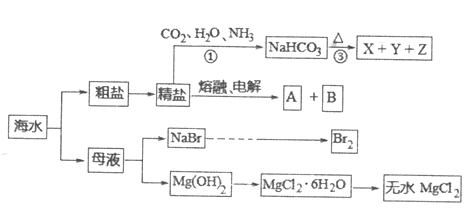
回答下列问题:
(1)精盐中非金属离子的核外电子排布式_________________________________
(2)A常温下为气体,A的电子式是_________________________________
(3)反应①中两种氢化物稳定性比较______________>__________________填化学式)
(4)反应①③是侯氏制碱反应,反应中可循环使用的物质是__________________填化学式)
(5)写出侯氏制碱反应①的化学反应方程式_________________________________
(6)在空气中直接加热![]() 的最终产物是______________________________填化学式)
的最终产物是______________________________填化学式)
(7)将406![]() 加热至450℃,固体质量减少至153g,此时固体产物的化学式是_____________________________。
加热至450℃,固体质量减少至153g,此时固体产物的化学式是_____________________________。
(8)除去粗盐中![]() 离子所需试剂及正确顺序____________________________
离子所需试剂及正确顺序____________________________
a.NaOH溶液 b.稀硫酸 c. ![]() 溶液 d.
溶液 d. ![]() 溶液 e.
溶液 e. ![]() 溶液 f.盐酸
溶液 f.盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁电池是一种新兴的化学电源,总反应方程式:3Zn+2FeO42﹣+8H2O=3Zn(OH)2↓+2Fe(OH)3↓+4OH﹣,其工作示意图如下。下列说法不正确的是( )

A. Zn 极上发生氧化反应
B. 电解质溶液中电子由左侧向右侧转移
C. 正极的电极反应式:FeO42﹣+3e﹣+4H2O=Fe(OH)3+5OH﹣
D. 反应一段时间后,Zn 极质量减少 6.5g,假设反应前后溶液体积不变仍为 100 mL,则 OH﹣浓度约增大了 1.33 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】流动电池是一种新型电池。其主要特点是可以通过电解质溶液的循环流动,在电池外部调节电解质溶液,以保持电池内部电极周围溶液浓度的稳定。北京化工大学新开发的一种流动电池如图所示,电池总反应为Cu+PbO2+2H2SO4=CuSO4+PbSO4+2H2O。下列说法不正确的是

A.a为负极,b为正极
B.该电池工作时PbO2电极附近溶液的pH增大
C.a极的电极反应为Cu-2e-=Cu2+
D.调节电解质溶液的方法是补充CuSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,取一张用饱和的 NaCl 溶液浸湿的 pH 试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现 a 电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色(b电极附近的试纸变化没有表示出来)。则下列说法错误的是( )

A. a电极是阳极
B. a 电极与电源的正极相连
C. 电解过程中水是氧化剂
D. b 电极附近溶液的 pH 变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、已知:N2(g)+3H2(g)![]() 2NH3(g)△H=-92.4kJ/mol,这是目前普遍使用的人工固氮的方法。请回答下列问题:
2NH3(g)△H=-92.4kJ/mol,这是目前普遍使用的人工固氮的方法。请回答下列问题:
450℃时,往一个2L的密闭容器中充入2. 6mol H2和1mol N2, 反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
c(NH3)/mol·L—1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
(1)此条件下该反应的化学平衡常数K=_______________;反应达到平衡后,若往平衡体系中加入H2、N2和NH3各2mol,此时该反应的v(N2)正____________v(N2)逆(填写“>”、“=”或“<”=)。
(2)若改变某一条件,达新平衡时n(H2)=1.60mol ,下列说法正确的是_____________。
A.平衡可能正向移动 B.可能是向容器中加入了一定量的H2气体
C.可能是降低了容器的温度 D.可能是增大了容器的体积
Ⅱ、已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
(1)若溶液中只溶解了一种溶质,该溶质的名称是__________,上述离子浓度大小顺序关系中正确的是(选填序号)_________________________。
(2)若上述关系中C是正确的,则溶液中溶质的化学式是______________
(3)若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)(填“>”、“<”、或“=”,下同)_____c(NH3·H2O),混合后溶液中c(NH4+)与c(Cl-)的关系c(NH4+)______c(Cl-)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如下图所示。
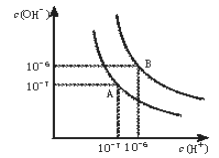
(1)若以A点表示25℃时水在电离平衡时的离子浓度, 当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从_____________增加到_____________。
(2)在100℃下,将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为______________。
(3)在某温度下,Ca(OH)2的溶解度为0.74 g,其饱和溶液密度设为1 g/mL,其离子积约为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com