

| ||
| ||


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、0.22mol |
| B、0.15mol |
| C、0.1mol |
| D、0.05mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
 往100mLNaOH溶液中通入CO2,充分反应后,在减压和较低温度下,小心将溶液蒸干,得白色固体M.通入标况下CO2的体积V(CO2)(单位:mL)与M的质量(w)(单位:g)的关系如图:
往100mLNaOH溶液中通入CO2,充分反应后,在减压和较低温度下,小心将溶液蒸干,得白色固体M.通入标况下CO2的体积V(CO2)(单位:mL)与M的质量(w)(单位:g)的关系如图:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
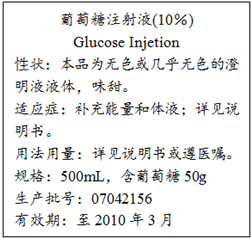 如图是某医院输液用的一瓶葡萄糖注射液标签的部分内容.据此回答以下问题(答案保留2位小数):
如图是某医院输液用的一瓶葡萄糖注射液标签的部分内容.据此回答以下问题(答案保留2位小数):查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
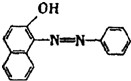 2005年4月10日,中央电视台发布“每周质量报告”,全国共有18个省市30家企业的88种食品样品中都检出了致癌物工业用染料“苏丹红I号”.苏丹红I号结构如图所示:
2005年4月10日,中央电视台发布“每周质量报告”,全国共有18个省市30家企业的88种食品样品中都检出了致癌物工业用染料“苏丹红I号”.苏丹红I号结构如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、观察颜色和状态 |
| B、观察是否能产生丁达尔现象(效应) |
| C、加入足量的盐酸 |
| D、滴入氢氧化钠溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com