
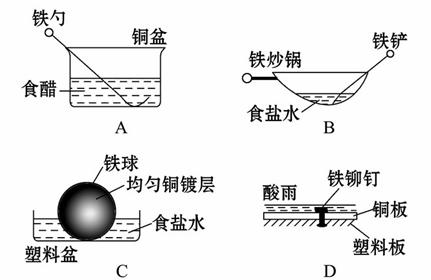
相同材质的铁在图中的四种情况下最不易被腐蚀的是
( )
科目:高中化学 来源: 题型:
室温下,在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH-浓度分别为a mol·L-1与b mol·L-1,则a和b的关系为( )
A.a>b B.a=10-4b C.b=10-4a D.a=b
查看答案和解析>>
科目:高中化学 来源: 题型:
某恒温密闭容器发生可逆反应Z(?)+W(?) X(g)+Y(?) ΔH,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中不正确的是( )
X(g)+Y(?) ΔH,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中不正确的是( )
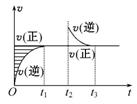
A.Z和W在该条件下一定不为气态
B.t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等
C.若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后的X浓度相等
D.若该反应只在某温度T0以上自发进行,则该反应的平衡常数K随温度升高而增大
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染。已知高铁酸盐热稳定性差,工业上用湿法制备高铁酸钾的基本流程如下图所示:
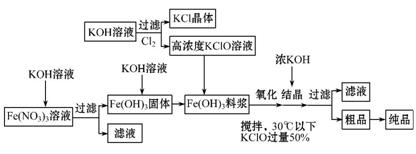
(1)上述氧化过程中,发生反应的离子方程式是 ,
控制反应温度30℃以下的原因是 。
(2)结晶过程中加入浓KOH溶液的作用是 。
(3)已知常温下Ksp[Fe(OH)3]=1.25×10-36,则Fe(NO3)3溶液中加入KOH溶液到
pH= 时,Fe3+才能完全沉淀(当溶液中某种离子浓度小于10-5mol·L-1时可看作完全沉淀,lg2=0.3,lg5=0.7),常温下反应Fe3++3H2O Fe(OH)3+3H+的平衡常数K= [水解生成的Fe(OH)3为胶体,其浓度不代入计算式,写出计算结果]。
Fe(OH)3+3H+的平衡常数K= [水解生成的Fe(OH)3为胶体,其浓度不代入计算式,写出计算结果]。
(4)最近,工业上用表面附有铁的氧化物的铁丝网作阳极,电解KOH溶液制备K2FeO4,优点是原料价廉,效率高。若用一表面附有Fe3O4的铁丝网20.0 g作阳极电解,当电路中通过1.4 mol电子时,铁丝网恰好电解完全。此时生成K2FeO4的质量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下列实验现象得出的结论正确的是( )
| 选项 | 实验现象 | 结论 |
| A | 将BaSO4浸泡在饱和Na2CO3溶液中,部分BaSO4转化为BaCO3 | Ksp(BaSO4)>Ksp(BaCO3) |
| B | 某溶液中加入盐酸酸化的BaCl2溶液,有白色沉淀生成 | 该溶液中一定存在SO |
| C | 滴有酚酞的Na2CO3溶液中加入BaCl2固体,红色变浅 | Na2CO3溶液中存在水解平衡 |
| D | 溴水中通入SO2,溴水褪色 | SO2具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.金属汞一旦洒落在实验室地面或桌面时,必须尽可能收集,并深埋处理
B.用pH计、电导率仪(一种测量溶液导电能力的仪器)均可监测乙酸乙酯的水解程度
C.邻苯二甲酸氢钾可用于标定NaOH溶液的浓度。假如称量邻苯二甲酸氢钾时电子天平读数比实际质量偏大,则测得的NaOH溶液浓度比实际浓度偏小
D.向某溶液中加入茚三酮试剂,加热煮沸后溶液若出现蓝色,则可判断该溶液含有蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
一种碳纳米管能够吸附氢气,可做二次电池(如下图所示)的碳电极。该电池的电解质为6 mol·L-1 KOH溶液,下列说法中正确的是( )
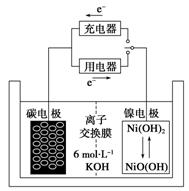
A.充电时阴极发生氧化反应
B.充电时将碳电极与电源的正极相连
C.放电时碳电极反应为H2-2e-===2H+
D.放电时镍电极反应为NiO(OH)+H2O+e-===Ni(OH)2+OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com