
如图所示,下列说法不正确的是 ( )。

A.反应过程(1)的热化学方程式为 A2 (g)+B2(g)===C(g) ΔH1=-Q kJ·mol-1
B.反应过程(2)的热化学方程式为C(g)===A2(g)+B2(g) ΔH2=+Q1 kJ·mol-1
C.Q与Q1的关系:Q>Q1
D.ΔH2>ΔH1
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
Mn、Fe均为第四周期过渡元素,两元素的部分电离能(I)数据列于下表:
| 元 素 | Mn | Fe | |
| 电离能 (kJ·mol-1) | I1 | 717 | 759 |
| I2 | 1 509 | 1 561 | |
| I3 | 3 248 | 2 957 |
回答下列问题:
(1)Mn元素价电子层的电子排布式为____________,比较两元素的I2、I3可
知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难。对此,你的
解释是___________________________________________________________。
(2)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成
配合物,则与Fe原子或离子形成配合物的分子或离子应具备的条件是
__________________________。
(3)三氯化铁常温下为固体,熔点282 ℃,沸点315 ℃,在300 ℃以上易升华。
易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为
____________晶体。
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。面心
立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为________。

查看答案和解析>>
科目:高中化学 来源: 题型:
某恒容密闭容器中充入一定量SO2和O2进行反应:2SO2(g)+O2(g)2SO3(g) ΔH<0,反应速率(v)与温度(T)、SO2的体积分数[V(SO2)%]与压强(p)的关系分别如图甲、图乙所示。下列说法不正确的是 ( )。

A.图甲中,曲线1表示逆反应速率与温度的关系
B.图甲中,d点表示温度为T0时,反应已经达到平衡
C.图乙中,温度恒定时,a、b两点对应的反应速率:va>vb
D.图乙中,温度恒定时,c点的反应正在向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
火力发电厂释放出大量二氧化碳,对燃煤废气进行脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。将CO2转化为甲醇是一种新型脱碳技术,其反应为CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH。
(1)取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图Ⅰ所示,则上述CO2转化为甲醇的反应的ΔH________0(填“>”、“<”或“=”)。
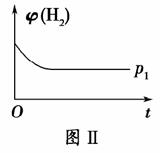

(2)如图Ⅱ是在恒温密闭容器中,压强为p1时H2的体积分数随时间t的变化曲线,请在图中画出该反应在p2(p2>p1)时H2的 体积分数随时间t的变化曲线。
(3)在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的物质的量浓度随时间的变化如图Ⅲ所示。

则0~10 min内,氢气的平均反应速率为________;该温度下,反应的平衡常数为________(保留三位有效数字);10 min后,向该容器中再充入1 mol CO2和3 mol H2,则再次达到平衡时CH3OH(g)的体积分数________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应的本质是旧化学键的断裂和新化学键的形成。已知某些化学键的键能数据如下:
| 化学键 | H—H | Cl—Cl | H—Cl |
| 键能/(kJ·mol-1) | 436 | 243 | 431 |
则下列热化学方程式不正确的是 ( )。
A.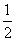 H2(g)+
H2(g)+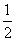 Cl2(g)===HCl (g)
Cl2(g)===HCl (g)
ΔH=-91.5 kJ· mol -1
B.H2 (g) +Cl2 (g) ===2HCl (g)
ΔH=-183 kJ· mol-1
C.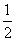 H2(g)+
H2(g)+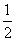 Cl2(g)===HCl (g)
Cl2(g)===HCl (g)
ΔH=+91.5 kJ· mol -1
D.2HCl (g) ===H2 (g)+Cl2 (g)
ΔH=+183 kJ· mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学发现在炽热的煤炭上洒少量水,煤炉中会产生淡蓝色的火焰,炉火更旺。因此该同学得出结论“煤炭燃烧时加少量水,可使煤炭燃烧时放出更多的热量”。已知:煤炭的燃烧热为 393.15 kJ · mol-1 ,氢气的燃烧热为 242 kJ· mol-1 ,一氧化碳的燃烧热为 283 kJ · mol-1 。下列有关说法正确的是
A.表示氢气燃烧热的热化学方程式为 2H2(g)+ O2(g)===2H2O (l) ΔH= -242 kJ · mol-1
B.表示CO 燃烧热的热化学方程式为 2CO(g)+ O2(g)===2CO2 (g) ΔH= - 566 kJ · mol-1
C.“炉火更旺”是因为少量的固体煤炭转化为可燃性气体
D.因 242 kJ·mol-1 +283 kJ· mol-1 >393.15 kJ·mol-1 ,故该同学的结论是对的
查看答案和解析>>
科目:高中化学 来源: 题型:
有关电化学知识的描述正确的是 ( )。
A.理论上说,任何能自发进行的氧化还原反应都可设计成原电池
B.某原电池反应为Cu+2AgNO3===Cu(NO3)2+2Ag,装置中的盐桥内可以是含琼脂的KCl饱和溶液
C.因为铁的活泼性强于铜,所以将铁、铜用导线连接后放入浓硝酸中组成原电池,必是铁作负极,铜作正极,其负极反应式为Fe-2e-===Fe2+
D.由Al、Mg与氢氧化钠溶液组成的原电池,其负极反应式为Mg-2e-+
2OH-===Mg(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,1.12 L CCl4含有C—Cl键数目为0.2NA
B.标准状况下,2.24 L氯气中含有的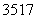 Cl数目一定为0.2NA
Cl数目一定为0.2NA
C.常温常压下,4.4 g CO2与N2O混合气体中含有的原子总数为0.3NA
D.80 mL 10 mol·L-1盐酸与足量MnO2加热反应,产生Cl2分子数小于0.2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com