
【题目】25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lgc(M2+)]与溶液pH的变化关系如图所示,已知该温度下Ksp[Cu(OH)2]<Ksp[Fe(OH)2]。下列说法正确的是
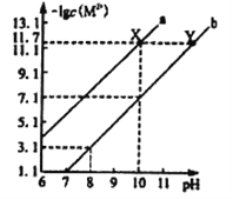
A. 曲线a表示Fe(OH)2饱和溶液中的变化关系
B. 除去CuSO4溶液中含有的少量Fe2+,可加入适CuO
C. 当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中c(Fe2+):c(Cu2+)=104.6 :1
D. 向X点对应的饱和溶液中加入少量NaOH固体,可转化为Y点对应的溶液
【答案】C
【解析】A、该温度下,Ksp[Cu(OH)2]<Ksp[Fe(OH)2],则c(Fe2+)>c(Cu2+),离子浓度越大,-lgC(M2+)值越小,则相同条件下,饱和溶液中C(Fe2+)较大,所以Fe(OH)2饱和溶液中-lgC(Fe2+)较小,则b线表示Fe(OH)2饱和溶液中的变化关系,故A错误;B、Ksp[Cu(OH)2]<Ksp[Fe(OH)2],Cu(OH)2更易生成沉淀,在含有Fe2+的CuSO4溶液中,加入适量CuO,不能生成Fe(OH)2沉淀,所以Fe2+浓度不变,故B错误;C、当pH=10时,-lgC(Cu2+)=11.7,则Ksp[Cu(OH)2]=10-11.7×(10-4)2=10-19.7,C(Fe2+):C(Cu2+)=Ks[Fe(OH)2]:Ksp[Cu(OH)2]=10-15.1:10-19.7=1:10-4.6=104.6:1,故C正确;D、向X点对应的饱和溶液中加入少量NaOH,溶液中会生成Cu(OH)2沉淀,溶液中铜离子的浓度会减小,而从X点到Y点铜离子浓度不变,故D错误;故选C。


科目:高中化学 来源: 题型:
【题目】升高温度能使反应速率加快,下列叙述正确的是( )
A. 降低反应所需的活化能
B. 使反应体系的活化分子百分数增大
C. 体系中活化分子总数不变
D. 对于吸热反应、放热反应,反应速率同等程度加大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表中前四周期的部分元素,表中所列的字母分别代表一种化学元素,根据要求回答下列各小题:
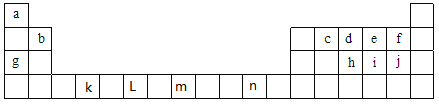
(1)①元素非金属性强弱比较有很多方法,其中f和j的非金属性强弱的研究方案中不可行的是_________(填序号)
a.比较两种单质的颜色 b.比较氢化物的稳定性 c.依据两元素在周期表的位置
d.比较电负性 e.比较最高价氧化物对应水合物的酸性
②根据元素原子的外围电子排布的特征,可将元素周期表前四周期元素分成4个区域,分别为s区、p区、d区、ds区,则属于s区的元素有_______种,属于d区的元素有_______种;元素n属于________区。
③在c、d、e三种元素中,电负性由小到大的顺序是______________,第一电离能由大到小的顺序是____________(用元素符号回答)。
(2)①写出 n2+的核外电子排布式:______________________。
②写出k元素基态原子的价电子排布式:_____________。
③写出 L元素基态原子的外围电子排布式:_____________。
④写出m元素基态原子价电子的轨道表示式:________________________,该元素在元素周期表中的位置为:__________________________。
⑤j简单阴离子的结构示意图为____________。
(3)①元素i的氢化物分子属于____________(填“极性”或“非极性”)分子,其分子的空间构型为____________,该氢化物分子中i原子轨道的杂化类型是__________; 由i与e形成的ie42-离子,其空间构型为__________(用文字描述)。
②已知cd- 与 d2 结构相似,1 mol cd- 中![]() 键数目为___________,由d形成的离子d3-与CO2互为等电子体,则d3-的分子构型为___________。
键数目为___________,由d形成的离子d3-与CO2互为等电子体,则d3-的分子构型为___________。
③f2通入稀NaOH溶液中可生成Of2,Of2分子构型为___________,其中氧原子的杂化方式为_______;
④化合物j2e的立体构型为_________,中心原子的价层电子对数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的5种短周期主族元素,其中仅含有一种金属元素,A单质是自然界中密度最小的气体,A和D最外层电子数相同;B元素原子结构示意图为![]() ;C和E在周期表中相邻,且E的质子数是C的2倍。请回答下列问题:
;C和E在周期表中相邻,且E的质子数是C的2倍。请回答下列问题:
(1)B位于第____________周期_____________族;
(2)E的离子结构示意图是_________________;DA中含有______________。(填化学键类型)
(3)用电子式表示BC2的形成过程________________________________________;(用具体元素表示)
(4)C、D、E三种元素简单离子的离子半径由大到小的顺序是______________________。(用具体离子符号表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列装置图
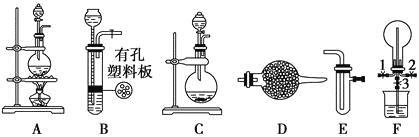
Ⅰ.探究氯气与氨气的反应
(1)为制取干燥氨气,可将装置C与____________(填装置编号)连接;装置C中的烧瓶内固体宜选用________________________。
a.碱石灰 b.氯化钙 c.五氧化二磷 d.浓硫酸
(2)装置A、E、E连接可制取纯净、干燥的氯气,A中发生的离子反应方程式为:_________________;则两个E装置内的药品依次是_________、_____________。
Ⅱ.探究某些物质的性质
(3)利用装置A、E,可设计实验比较Cl-和Br-的还原性强弱,能证明结论的实验现象_______________。
(4)若利用装置A、E进行乙烯与溴水反应的实验,写出反应的化学方程式_________________。
(5)将装置B、C分别与F相连后,进行H2S与SO2反应的实验。F的烧瓶中发生反应的化学方程式为________________;F的烧杯所起的作用是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的.周期数与主族序数相等。
![]()
请回答下列问题:
(1)W在周期表中的位置是____________________________________,Q、R、T三种元素原子半径由大到小的顺序为____________________________________________________________________。(用元素符号表示),QO2的电子式为________________________,R的最高价氧化物的化学式____________________________。
(2)T单质与NaOH 溶液反应的离子方程式为____________________________________________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图两瓶体积相等的气体,在同温同压时瓶内气体的关系一定正确的是( )

A. 所含原子数相等 B. 气体密度相等C.气体质量相等 D.摩尔质量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,等物质的量的乙烯和苯分别和足量氢气发生加成反应,消耗氢气的物质的量之比为( )。
A. 1∶1B. 1∶2C. 1∶3D. 1∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚磷酸二乙酯[HPO(OC2H5)2]为重要的阻燃增塑剂。实验室采用三氯化磷和无水乙醇制备亚磷酸二乙酯PCl3 + 4C2H5OH → HPO(OC2H5)2 + HCl↑+2C2H5Cl + H2O;实验步骤如下:
①将40mL三氯甲烷和36.8g(0.8mol)无水乙醇混合后加入250mL三颈烧瓶中。
②从仪器A中滴加20mL三氯甲烷和27.5g (0.2mol)PCl3混合溶液,用冰水控温6~8℃,开动搅拌器,约1h滴加完毕。
③将反应物倒入烧杯中,用10%的碳酸钠溶液中和至pH为7~8,再用去离子水洗涤三次,在仪器B中分离。
④减压蒸馏,收集产品,得23.32g产品。
(1)装置图中仪器A叫做恒压滴液漏斗,与分液漏斗比,滴液时的优点是 ;步骤③中仪器B名称为 。图中NaOH溶液的作用为 。
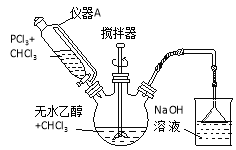
(2)用碳酸钠溶液洗涤的目的是 ;用去离子水洗涤的目的是 。
(3)减压蒸馏除得到产品外还可回收的有机物有 (写两个的结构简式)。
(4)从无水乙醇利用角度计算,本次实验产率为 (填数值)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com