
【题目】常温下,在10mL0.1mol/LNa2CO3溶液中逐滴加入0..1mol/LHCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法不正确的是
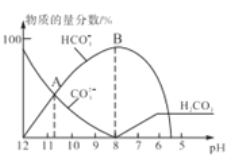
A. 常温下,水解常数Kh(CO32-)的数量级为10-4
B. 当溶液是中性时,溶液的总体积大于20mL
C. 在0.1mol/LNa2CO3溶液中:c(OH-)>c(H2CO3)+c(HCO3-)+c(H+)
D. 在B点所示的溶液中,离子浓度最大的是HCO3-
【答案】D
【解析】分析:由A点可以确定碳酸的二级电离常数和碳酸根的水解常数。碳酸钠溶液和碳酸氢钠溶液都呈碱性。根据质子守恒可以判断相关离子浓度的大小关系。
详解:A. 由图中信息可知,A点c(HCO3-)=c(CO32-),则水解常数Kh(CO32-)![]() ,A点对应的11>pH>10,则
,A点对应的11>pH>10,则![]() ,所以,水解常数Kh(CO32-)的数量级为10-4,A正确;
,所以,水解常数Kh(CO32-)的数量级为10-4,A正确;
B. 0.1mol/LNa2CO3溶液呈碱性,当加入10mL 0..1mol/LHCl溶液时碳酸根全部转化为碳酸氢根,此时溶液仍呈碱性,所以,当溶液是中性时,溶液的总体积大于20mL,B正确;
C. 在0.1mol/LNa2CO3溶液中,由质子守恒可知,c(OH-)=2c(H2CO3)+c(HCO3-)+c(H+),所以,c(OH-)>c(H2CO3)+c(HCO3-)+c(H+),C正确;
D. 由物料守恒可知,在B点所示的溶液中,离子浓度最大的是Na+,D不正确。
本题选D。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】粉末状样品A是由等物质的量的MgO和Al2O3与常见金属氧化物B组成的混合物。A有如图所示的转化关系。
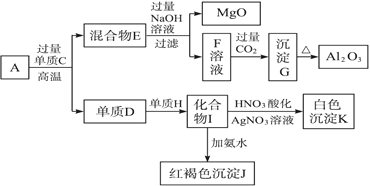
请完成下列问题:
(1) 金属单质C和非金属单质H的化学式分别是__________、_______________
(2) 写出由I生成J的离子方程式:___________________
(3) 写出由F生成G的离子方程式:____________________________
(4) 若10.7 g样品A中MgO、Al2O3和B的物质的量均为0.05 mol,则B的化学式为___________。
(5) 若B中金属原子与氧原子的粒子数之比为2∶3,取7.10 g样品A恰好与含x mol HCl的盐酸完全反应,则x的取值范围是___________(保留小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置,其中试剂b为浓硫酸,则下列实验设计能达到实验目的的是
选项 | 试剂a | 试剂c | 实验目的 |
|
A | MnO2和NaCl | 紫色石蕊溶液 | 验证Cl2的漂白性 | |
B | 蔗糖 | 澄清石灰水 | 验证CO2的生成 | |
C | FeS | 溴水 | 验证非金属性:Br>S | |
D | Na2SO3 | 品红溶液 | 验证SO2的漂白性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类是学习和研究化学的一种重要方法,下列分类合理的是( )
A.K2CO3和K2O都属于盐
B.H2SO4和NaHSO4都属于酸
C.KOH和NH3H2O都属于碱
D.Na2O和Na2SiO3都属于氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类生存、社会发展不可或缺的物质,CO、H2、CH3OH均是重要的能源物质。
(1)已知:氧气中化学键的键能为497kJ/mol,二氧化碳中C=O键的键能为745kJ/mol。
2CO(g)+O2(g)=2CO2(g) △H1=-566kJ/mol
H2O(g)+CO(g)=H2(g)+CO2(g) △H2=-41kJ/mol
CH3OH(g)+![]() O2(g)==CO2(g)+2H2O(g) △H3=-660kJ/mol
O2(g)==CO2(g)+2H2O(g) △H3=-660kJ/mol
CO(g)+2H2(g)![]() CH3OH(g) △H4
CH3OH(g) △H4
则使1molCO(g)完全分解成原子所需要的能量至少为___,△H4=___。
(2)某密闭容器中存在反应:CO(g)+2H2(g)![]() CH3OH(g),起始时容器中只有amol/LCO和bmol/LH2,平衡时测得混合气体中CH3OH的物质的量分数[φ(CH3OH)]与温度(T)、压强(p)之间的关系如图所示。
CH3OH(g),起始时容器中只有amol/LCO和bmol/LH2,平衡时测得混合气体中CH3OH的物质的量分数[φ(CH3OH)]与温度(T)、压强(p)之间的关系如图所示。
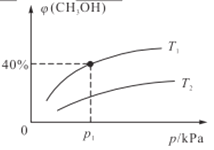
①温度T1和T2时对应的平衡常数分别为K1、K2,则K1____K2(填“>”“<”“=”);若恒温(T1)恒容条件下,起始时a=1、b=2,测得平衡时混合气体的压强为p1kPa,则T1时该反应的压强平衡常数Kp=___。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,用含p1的代数式表示)
②若恒温恒容条件下,起始时充入1molCO和2molH2,达平衡后,CO的转化率为α1,此时,若再充入1molCO和2molH2,再次达平衡后,CO的转化率为α2,则α1_____α2 (填“>”“<”“=”“无法确定”)
③若恒温恒容条件下,起始时a=1、b=2,则下列叙述能说明反应达到化学平衡状态的是____。
A.CO、H2的物质的量浓度之比为1:2,且不再随时间的变化而变化
B.混合气体的密度不再随时间的变化而变化
C.混合气体的平均摩尔质量不再随时间的变化而变化
D.若将容器改为绝热恒容容器时,平衡常数K不随时间变化而变化
(3)工业上常用氨水吸收含碳燃料燃烧中产生的温室气体CO2,其产物之一是NH4HCO3。已知常温下碳酸的电离常数K1=4.4×10-7、K2=4.7×10-11,NH3·H2O的电离常数K=1.8×10-5,则所得到的NH4HCO3溶液中c(NH4+)_____c(HCO3-)(填“>”“<”“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答以下问题:
(1)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为___________;
(2)CuSO4粉末常用来检验一些有机物中的微量水分,其原因是_______;
(3)SO42-的立体构型是________,其中S原子的杂化轨道类型是_______;
(4)元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子最外层电子排布式为______;一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为_______;该晶体中,原子之间的作用力是________;
(5)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构为CaF2的结构相似,该晶体储氢后的化学式应为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳的氧化物和氮的氧化物与人类生活息息相关,它们之间有多种相互转化关系,可以变废为宝。
(1)为了模拟汽车尾气在催化转化器内的工作反应情况,控制定条件,让反应在恒容密闭容器中进行如下反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g),用传感器测得不同时间NO和CO的依度如下表:
N2(g)+2CO2(g),用传感器测得不同时间NO和CO的依度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)(10-4mol/L) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(NO)(10-3mol/L) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①前2s内的平均反应速率v(N2)=________,此温度下,该反应的平衡常数K=_______
②能说明上述反应达到平衡状态的是____________。
A.2n(CO2)=n(N2) B.混合气体的平均相对分子质量不变
C.气体密度不变 D.容器内气体压强不变
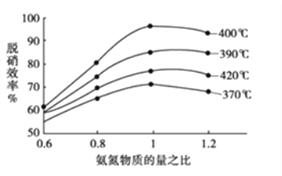
③当NO与CO浓度相等时,体系中NO的平衡转化率与温度、压强的关系如图所示。则NO的平衡转化率随温度升高而减小的原因是___,压强P1、P2、P3的大小关系是____________,理由是_______________________。
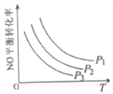
(2)用氨气催化氧化还原法脱硝(NOx)
①根据下图判断提高脱硝效率(单位时间内NOx浓度变化占烟气初始浓度的百分比)的最佳条件是:______________________。
②已知:N2(g)+O2(g)=2NO(g) △H=+akJ/mol
N2(g)+3H2(g)![]() 2NH3(g) △H=-bk/mol
2NH3(g) △H=-bk/mol
2H2(g)+O2(g)=2H2O(g) △H=-ckJ/mol 其中a、b、C均为大于0。
则放热反应:4NO(g)+4NH3(g)+O2(g)![]() 4N2(g)+6H2O(g) △H=____________。
4N2(g)+6H2O(g) △H=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有资料显示过量的氨气和氯气在常温下可合成岩脑砂(主要成分为NH4Cl),某实验小组对该反应进行探究,并对岩脑砂进行元素测定。回答下列问题:
I.岩脑砂的制备
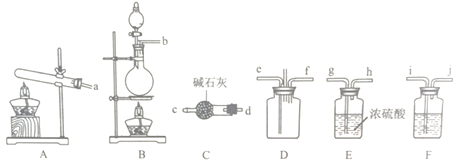
(1)该实验中用浓盐酸与二氧化锰反应制取所需氯气,写出该反应的化学反应方程式_____,装置F中的试剂是___________(填试剂名称)。
(2)为了使氨气和氯气在D中充分混合,请确定上述装置的合理连接顺序:a→____→ef←___(用小写字母和箭头表示,箭头方向与气流方向一致)。
(3)装置D处有两个明显的不足之处,其中之一为:导管太细,生成的氯化按固体会堵塞导管,之二为:___________。
(4)证明氨气和氯气反应有岩脑砂生成,需要的检验试剂(试纸)中,除了蒸馏水、稀HNO3、NaOH溶液外,还需要______。热的浓氯化铵溶液可以清洗溶解铁器表面锈迹,写出相关反应的离子方程式_________________。
II.岩脑砂中元素的测定
准确称取ag岩脑砂,与足量的氧化铜混合加热(2NH4Cl+3CuO![]() 3Cu+N2↑+2HC1↑+3H2O),利用下列装置测定岩脑砂中氮元素和氯元素的质量之比。
3Cu+N2↑+2HC1↑+3H2O),利用下列装置测定岩脑砂中氮元素和氯元素的质量之比。
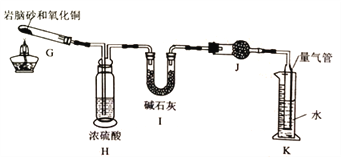
(5)设置装置H的目的是______________。
(6)若装置I增重bg,利用装置K洲得气体体积为VL(已知常温常压下气体摩尔体积为24.5L/mol),则岩脑砂中m(N):m(Cl)=_____(用含b、V的代数式表示,不必化简)。若测量体积时气体温度高于常温(其他操作均正确且忽略气体摩尔体积的改变),则m(N)比正常值______(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com