
| 实验编号 | 0.01mol•L-1酸性KMnO4溶液 | 0.1mol•L-1H2C2O4溶液 | 水 | 1mol•L-1MnSO4溶液 | 反应温度/℃ | 反应时间 |
| Ⅰ | 2mL | 2mL | 0 | 0 | 20 | 125 |
| Ⅱ | V1 mL | V2 mL | 1mL | 0 | 20 | 320 |
| Ⅲ | V3 mL | V4 mL | V5mL | 0 | 50 | 30 |
| Ⅳ | 2mL | 2mL | 0 | 2滴 | 20 | 10 |
分析 (1)利用高锰酸钾的颜色来判断;
(2)实验I和II研究浓度对反应速率的影响,温度相同,浓度不同;实验I和III研究温度对反应速率的影响,浓度相同中,温度不同;
(3)实验I和实验IV对比,其他条件相同,实验IV加入MnSO4溶液为催化剂;
(4)该反应中Mn元素化合价由+7价变为+2价、C元素化合价由+3价变为+4价,根据转移电子守恒、原子守恒配平方程式.
解答 解:(1)实验计时方法是从溶液混合开始记时,到紫红色刚好褪去计时结束,故答案为:紫红色刚好褪去;
(2)根据实验目的,选择合理数据:高锰酸钾本身作为指示剂,浓度不变,都是2mL,V1=2mL,V3=2mL;实验I和II研究浓度对反应速率的影响,用水来控制溶液的总体积相同,所以草酸体积V2=1mL;实验I和III研究温度对反应速率的影响,浓度全部相同,V4=2mL,V5=0mL,
故答案为:2;1;2;2;0;
(3)从实验数据分析,实验I和实验IV对比,其他条件相同,实验IV加入MnSO4后反应速率加快,所以MnSO4溶液在反应中为催化剂,故答案为:催化剂;
(4)该反应中Mn元素化合价由+7价变为+2价、C元素化合价由+3价变为+4价,其转移电子总数为10,根据转移电子守恒知,KMnO4的计量数是2、H2C2O4的计量数是5,再根据原子守恒得方程式为2KMnO4+5H2C2O4+3H2SO4═1K2SO4+10CO2↑+2MnSO4+8H2O,
故答案为:2;5;3;1;2;10;8.
点评 本题考查影响化学反应速率的因素、氧化还原反应的配平,需要认真分析题中信息,得出合理结论,本题难度中等.


科目:高中化学 来源: 题型:解答题
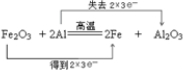 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图为实验室制取少量乙酸乙酯的装置图,下列关于该实验的叙述中,不正确的是( )
如图为实验室制取少量乙酸乙酯的装置图,下列关于该实验的叙述中,不正确的是( )| A. | 向a试管中先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,再加冰醋酸 | |
| B. | 试管b中导气管下端管口不能浸入液面的原因是防止实验过程中发生倒吸现象 | |
| C. | 实验时试管b中饱和Na2CO3溶液的作用是吸收乙醇、中和乙酸及降低乙酸乙酯的溶解度便于分层 | |
| D. | 长玻璃导管只有导气的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
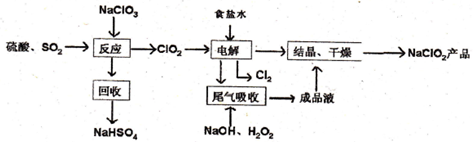
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
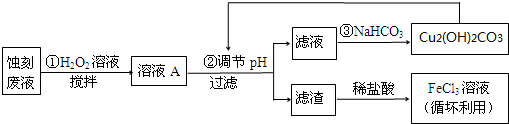
| Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 4.7 | 7.0 | 1.9 |
| 沉淀完全时 | 6.7 | 9.0 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤③②⑥ | B. | ④①③⑤②⑥ | C. | ⑤④③①②⑥ | D. | ③④⑤①②⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
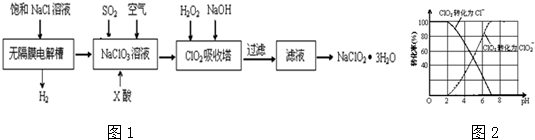
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
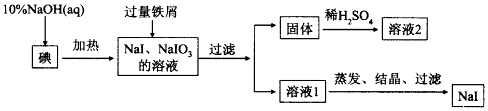
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com