
已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E的+1价阳离子的核外有3层电子且各层均处于全满状态。
(1)E元素基态原子的核外电子排布式为__________________________ ______________________________________________。
(2)B、C、D三种元素的第一电离能由小到大的顺序为________(填元素符号),其原因是__________________________________________ ______________________________。
(3)B2A4是石油炼制的重要产物之一 。B2A4分子中B原子轨道的杂化类型为________;1 mol B2A2分子中含________mol σ键。
(4)已知D、E能形成晶胞结构如图所示的两种化合物,则化学式:甲为____________________,乙为______________________;高温时,甲易转化为乙的原因为______________________________。

解析 原子序数与周期数、族序数都相等的元素只有氢元素,即A为氢元素;B原子核外电子有6种不同的运动状态,因原子核外电子运动状态互不相同,故B为碳元素;L层有两对成对电子,则该层电子排布为2s22p4,即D为氧元素,则C为氮元素;E的+1价阳离子的核外有3层电子且各层均处于全满状态,则E元素应为第ⅠB族的铜元素。(2)同周期元素的第一电离能从左到右呈增大趋势,但由于氮元素的2p轨道处于半满状态,较稳定,故其第一电离能大于相邻的碳元素和氧元素,故第一电离能的大小顺序为N>O>C。(3)C2H4分子中碳原子的成键电子对数为(4+2)/2=3,故碳原子的轨道杂化类型为sp2杂化。(4)甲晶胞中白色球有8个处于顶点、4个处于棱上、2个处于面心、1个处于体心:8×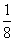 +4×
+4×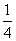 +2×
+2×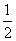 +1=4,4个黑色球均处于晶胞体内,故甲晶胞的化学式为CuO。乙晶胞中白色球代的元素8个处于顶点、1个处于体心:8×
+1=4,4个黑色球均处于晶胞体内,故甲晶胞的化学式为CuO。乙晶胞中白色球代的元素8个处于顶点、1个处于体心:8×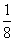 +1=2,黑色球4个均处于晶胞体内,故乙晶胞的化学式为Cu2O。CuO和Cu2O中铜的化合价分别为+2、+1,故CuO和Cu2O中的铜原子的电子排布式分别为1s22s22p63s23p63d9、1s22s22p63s23p63d10,Cu2O中铜的各轨道均处于全满状态,性质稳定。
+1=2,黑色球4个均处于晶胞体内,故乙晶胞的化学式为Cu2O。CuO和Cu2O中铜的化合价分别为+2、+1,故CuO和Cu2O中的铜原子的电子排布式分别为1s22s22p63s23p63d9、1s22s22p63s23p63d10,Cu2O中铜的各轨道均处于全满状态,性质稳定。
答案 (1)1s22s22p63s23p63d104s1或3d104s1
(2)C<O<N 同一周期从左向右,元素的第一电离能呈现逐渐增大的趋势,但氮元素的最外层电子达到半充满的稳定构型,故其第一电离能大于氧元素的
(3)sp2 5
(4)CuO Cu2O Cu2O中Cu的各轨道均为全充满状态,较稳定


科目:高中化学 来源: 题型:
H2O2是一种绿色氧化还原试剂,在化学研究中应用广泛。
(1)某小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响。限选试剂与仪器:30% H2O2、0.1mol∙L-1Fe2(SO4)3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器
①写出本实验H2O2分解反应方程式并标明电子转移的方向和数目:__ __________
__________
②设计实验方案:在不同H2O2浓度下,测定 ____________________________________(要求所测得的数据能直接体现反应速率大小)。
③设计实验装置,完成下图的装置示意图。
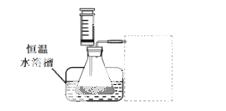
④参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母表示)。
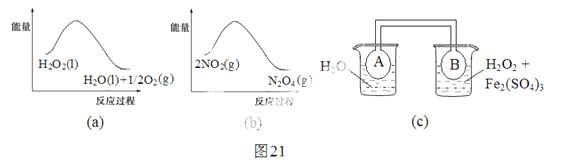
(2)利用图21(a)和21(b)中的信息,按图21(c)装置(连能的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的_________(填“深”或“浅”),其原因是______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数的值,下列叙述中不正确的是:
A.常温常压下,1mol甲基(-CH3)含有的电子数为9NA
B.1 mol FeCl3跟水完全反应转化为氢氧化铁胶体后胶体粒子的数目小于NA
C.标况下,2.24LHF中含有的电子数为NA
D.1 mol 金刚砂(SiC)中含有4NA碳硅键
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列叙述错误的是( )
A.常温常压下,8.8g CO2和N2O混合气体中所含的电子数为4.4NA
B.5.6 g铁与500 mL 2 mol·L-1硝酸反应,转移的电子数为0.2NA
C.常温常压下,0.4 mol Na2O2与足量H2O反应,共生成0.2 mol O2,转移电子的数目为0.4NA
D. V La mol·L-1的氯化铁溶液中,若Fe3+的数目为6.02×1023,则Cl-的数目大于3×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
原子序数小于36的X、Y、Z、W、J五种元素,原子序数依次增大,其中X元素原子半径是所有元素原子中最小的,Y元素原子核外有三种不同的能级且各个能级所填充的电子数相同,W元素原子最外层电子数是内层电子数的3倍,J元素原子序数为24。请回答下列问题。
(1)Y、Z、W的第一电离能由小到大的顺序为________。
(2)J原子的核外电子排布式为___________________________ _____________________________________________。
(3)Y2X2分子中Y原子轨道的杂化类型为________。1 mol Y2X2分子中含有σ键与π键的数目之比为____________________________ ____________________________________________。
(4)Z与W形成的一种Z2W分子,与该分子互为等电子体的阴离子为________(任写一种)。
(5)JCl3能与Z、W的氢化物形成配位数为6的络合物,且相应两种配体的物质的量之比为2:1,氯离子全部位于外界。则该配合物的化学式为________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知2Zn(s)+O2(g)= 2ZnO(s);ΔH=-700 kJ/mol,则1 g Zn在氧气中燃烧放出的热量约为( )
A.5.4 kJ B.350 kJ C.3.5 kJ D.8.5 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子反应方程书写正确的是 ( )
A. H2O + H2O 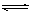 H3O+ + OH— B. CO32—+ 2H2O
H3O+ + OH— B. CO32—+ 2H2O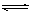 H2CO3 + 2OH—
H2CO3 + 2OH—
C. Ca(OH)2 + 2H+ 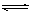 Ca2+ + 2H2O D. Al3++3H2O == Al(OH)3↓ + 3H+
Ca2+ + 2H2O D. Al3++3H2O == Al(OH)3↓ + 3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
镁是生产铝合金必需的添加材料。镁合金被公认为“21世纪绿色环保新型材料”,可广泛运用于航空航天、汽车等10多个领域。现把镁条投入到盛有盐酸的敞口容器中,产生H2的速率如图所示。在下列因素中对产生H2速率没有影响的是( )
A.溶液的温度 B.镁条的表面积
C.Cl-的浓度 D.H+的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
完全中和50ml物质的量浓度为2mol/LnaOH
溶液需要H2SO4的质量是多少?若将这些H2SO4溶于水配成500ml溶液,求H2SO4的物质的量浓度是多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com