
分析 (1)根据v=$\frac{△c}{△t}$计算v(B),再根据速率之比等于化学计量数之比计算v(A);
(2)生成C的物质的量为0.4mol/L×2L=0.8mol,反应B的物质的量为2mol-1.8mol=0.2mol,则1:x=0.2:0.8,解得x=4,再计算平衡时各组分浓度,代入K=$\frac{{c}^{4}(C)}{{c}^{3}(A)×c(B)}$计算;
(3)该反应属于可逆反应,将3molA和足量B混合后在同一容器中充分反应,参加反应的A小于3mol;
(4)若向原平衡混合物的容器中再通入a molC,在t℃达到新的平衡,欲使新平衡时各物质的体积分数与原平衡相同,为等效平衡,恒温恒容下,反应前后气体物质的量不变,则按化学计量数完全转化到左边满足n(A):n(B)=3:2;
恒温恒容下,压强之比等于物质的量之比.
解答 解:(1)5s时反应达到平衡状态(温度不变),剩余1.8mol B,则v(B)=$\frac{\frac{2mol-1.8mol}{2L}}{5s}$=0.02mol/(L.min),速率之比等于化学计量数之比,v(A)=2v(B)=0.04mol/(L.min),
故答案为:0.04mol/(L.min);
(2)生成C的物质的量为0.4mol/L×2L=0.8mol,反应B的物质的量为2mol-1.8mol=0.2mol,则1:x=0.2:0.8,解得x=4,
3A(g)+B(g)?4C(g)
起始量(mol):3 2 0
变化量(mol):0.6 0.2 0.8
平衡量(mol):2.4 1.8 0.8
平衡常数K=$\frac{{c}^{4}(C)}{{c}^{3}(A)×c(B)}$=$\frac{(\frac{0.8}{2})^{4}}{(\frac{2.4}{2})^{3}×\frac{1.8}{2}}$=0.0165,
故答案为:4;$\frac{4}{243}$;
(3)该反应属于可逆反应,将3molA和足量B混合后在同一容器中充分反应,参加反应的A小于3mol,则放出的热量<Q kJ,
故答案为:A;
(4)若向原平衡混合物的容器中再通入a molC,在t℃达到新的平衡,欲使新平衡时各物质的体积分数与原平衡相同,为等效平衡,恒温恒容下,反应前后气体物质的量不变,则按化学计量数完全转化到左边满足n(A):n(B)=3:2,由于转化得到A、B之比为3:1,则需要加入B物质,设进而B为xmol,则(3+$\frac{3}{4}$a):(2+x+$\frac{1}{4}$c)=3:2,解得x=0.25a,
反应气体混合物总物质的量不变,恒温恒容下,压强之比等于物质的量之比,故新条件下的平衡与最初的平衡状态时的压强比为(5+a+0.25a):5=(1+0.25a):1,
故答案为:0.25a;B;(1+0.25a):1.
点评 本题考查化学平衡计算、反应速率计算等,(4)中关键是对等效平衡规律的理解,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 先后滴加紫色石蕊试液、BaCl2溶液,可以将盐酸、硫酸、硫酸钠、氢氧化钠和硝酸钾五种无色溶液鉴别开 | |
| B. | 用加入过量CuCl2溶液,再过滤,除去Cu(NO3)2溶液中混有的AgNO3 | |
| C. | 向某无色未知溶液中仅加入BaCl2溶液,以检验未知溶液中的SO42- | |
| D. | 某固体在加入稀盐酸产生了无色无味且能使澄清石灰水变浑浊的气体,证明该固体一定含有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/s | 0 | 50 | 100 |
| c(N2O5)/mol•L-1 | 5.0 | 3.5 | 2.4 |
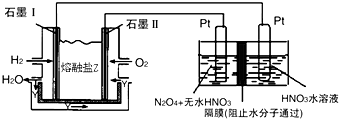
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
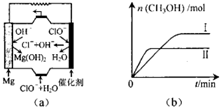 “低碳生活”既是时尚,也是环保要求.目前碳及其化合物的综合利用已成为科学家研究的重要课题.
“低碳生活”既是时尚,也是环保要求.目前碳及其化合物的综合利用已成为科学家研究的重要课题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
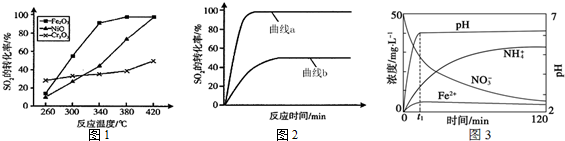
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
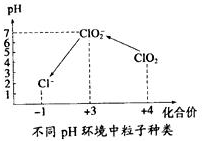 二氧化氯(C1O2)气体是一种常用高效的自来水消毒剂.
二氧化氯(C1O2)气体是一种常用高效的自来水消毒剂.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com