
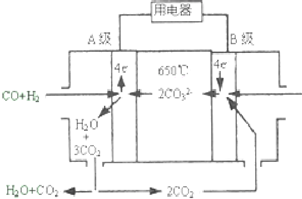
 熔融碳酸盐燃料电池(MCFS),发明于1889年.现有一个碳酸盐燃料电池,以一定比例Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1:1)直接作燃料,其工作原理如图所示.请回答下列问题:
熔融碳酸盐燃料电池(MCFS),发明于1889年.现有一个碳酸盐燃料电池,以一定比例Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1:1)直接作燃料,其工作原理如图所示.请回答下列问题:分析 (1)该燃料电池中,负极上一氧化碳、氢气失电子和碳酸根离子反应生成二氧化碳和水;
(2)电池总反应为一氧化碳、氢气与氧气反应生成二氧化碳和水;
(3)水煤气0.56L(已换算为标况)的物质的量为$\frac{0.56L}{22.4L/mol}$=0.025mol,结合电极方程式计算转移的电子;
(4)0.4mol/L的碳酸钠与等体积0.2mol/L的盐酸混合,混合后溶液中溶质为碳酸钠、碳酸氢钠、氯化钠,其浓度均为0.1mol/L,结合电荷守恒和物料守恒分析.
解答 解:(1)该燃料电池中,负极的气体按物质的量之比为1:1参与反应,A极通入燃料,则A极为负极;负极上一氧化碳、氢气失电子和碳酸根离子反应生成二氧化碳和水,电极反应式为CO+H2-4e-+2CO32-=3CO2+H2O,
故答案为:负;CO+H2-4e-+2CO32-=3CO2+H2O;
(2)电池总反应为一氧化碳、氢气与氧气反应生成二氧化碳和水,则电池总反应方程式为:CO+H2+O2=CO2+H2O;
故答案为:CO+H2+O2=CO2+H2O;
(3)水煤气0.56L(已换算为标况)的物质的量为$\frac{0.56L}{22.4L/mol}$=0.025mol,已知电极反应式为CO+H2-4e-+2CO32-=3CO2+H2O,则转移电子的物质的量为0.025mol×$\frac{1}{2}$×4=0.05mol;
故答案为:0.05mol;
(4)0.4mol/L的碳酸钠与等体积0.2mol/L的盐酸混合,混合后溶液中溶质为碳酸钠、碳酸氢钠、氯化钠,其浓度均为0.1mol/L,溶液中c(Na+)=0.4mol/L,c(H+)=10-10mol/L,c(OH-)=10-4mol/L,c(Cl-)=0.1mol/L,溶液中的电荷守恒为c(Na+)+c(H+)=c(Cl-)+c(HCO3-)+c(OH-)+2c(CO32-),物料守恒为c(H2CO3)+c(HCO3-)+c(CO32-)=0.2mol/L,则c(HCO3-)+2c(H2CO3)=0.1+10-4-10-10mol/L;
故答案为:0.1+10-4-10-10mol/L.
点评 本题考查电化学电极反应式和的书写、原电池的计算、溶液中电荷守恒和物料守恒的应用等知识,明确发生的电极反应及反应中转移的电子数、溶液中电荷守恒和物料守恒原理即可解答,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,46gNO2含有2NA个分子 | |
| B. | 标准状况下,1.12L1H2和0.2g2H2均含有0.1NA个质子 | |
| C. | 室温时,1LpH=2的NH4Cl溶液中水电离出H+的数目为10-12NA | |
| D. | 过氧化氢分解制得标准状况下1.12LO2,转移的电子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2 | B. | CO | C. | CO2 | D. | SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

 ②
② ③
③ ④
④ ⑤
⑤
 ⑦
⑦
| A. | ①②③ | B. | ⑦ | C. | ④⑤⑥⑦ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
 .
. ,②元素形成的单质其结构式为N≡N.
,②元素形成的单质其结构式为N≡N.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用CCl4萃取碘水中的I2 | B. | 粗盐(混有泥沙、MgSO4•FeCl3)的提纯 | ||
| C. | 用蒸馏方法分离CCl4和I2的混合物 | D. | 用浓HCl配制一定量浓度的稀HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com