
【题目】根据要求回答下列问题:
I.氯系消毒剂在生活中有广泛应用。
(1)NaClO2是饮用水的消毒剂,常用FeSO47H2O清除残留的亚氯酸钠。
①Fe2+的电子排布式为[Ar]________________________________。
②与SO42-互为等电子体的分子有____________________(写一种)。
③ClO2-中氯原子的孤电子对数为___________。
④常用K3[Fe(CN)6]检验水中的F2+。K3[Fe(CN)6]的配体是________________。
(2)ClO2是新一代饮用水消毒剂。沸点:ClO2________________(填“>”“<”或“=”)Cl2O,理由是________________________________________________。
Ⅱ.Fe、Cu为过渡金属元素,它们在工业生产中都有重要的应用。
(2)将乙醇蒸气通过赤热的氧化铜粉末,会发生反应:![]()
①有同学书写基态碳原子的核外电子排布图为![]() ,这样的书写不正确,违背了________。
,这样的书写不正确,违背了________。
②乙醛和乙醇的相对分子质量相差2,但是乙醇的沸点远高于乙醛,其主要原因是_______。
(2)Fe、Fe2+都能被硝酸氧化。HNO3中氮原子轨道的杂化类型为_______________________。
(3)NO能被FeSO4溶液吸收生成配合物![]() ,该配合物中心离子的配位数为__________________________。
,该配合物中心离子的配位数为__________________________。
(4)研究发现,阳离子的颜色与未成对电子数有关。例如,Cu2+、Fe2+、Fe3+等。Cu+呈无色,其原因是_____________________________。
【答案】3d6 CCl4或SiF4 2 CN- < 后者相对分子质量较大,范德华力较大 洪特规则 乙醇分子间存在范德华力和氢键,乙醛分子间只存在范德华力 sp2 6 Cu+无未成对电子
【解析】
I.(1)①Fe2+为Fe失去最外层的2个电子形成的离子;
②与SO42-互为等电子体的分子,即含有5个原子,32个电子的分子;
③根据孤电子对数=![]() (a-bx)计算;
(a-bx)计算;
(2)分子晶体的分子量越大,分子间的作用力越大,熔沸点就越高。
I.(1)①铁为第26号元素,排布式为[Ar]3d64s2,Fe2+为Fe失去最外层的2个电子形成的离子,其排布式为[Ar]3d6;
②与SO42-互为等电子体的分子,即含有5个原子,32个电子的分子有四氯化碳、四氟化硅等;
③孤电子对数=![]() (a-bx)=
(a-bx)=![]() (7+1-2×2)=2;
(7+1-2×2)=2;
④[Fe(CN)6]3-为中心配离子,而CN-为配体;
(2)ClO2、Cl2O均为分子晶体,分子晶体的分子量越大,分子间的作用力越大,熔沸点就越高,则沸点:ClO2<Cl2O;
Ⅱ.(1)①根据洪特规则可知,在相同能级的电子,电子的自旋方向相同;
②乙醇分子间存在范德华力和氢键,氢键的作用力大于乙醛分子间的作用力,导致沸点升高;
(2)NO3-中心N原子的孤电子对数=![]() (a-bx)=
(a-bx)=![]() (5+1-2×3)=0,N原子与O原子间存在3条共价键,无孤电子对,则为sp2杂化;
(5+1-2×3)=0,N原子与O原子间存在3条共价键,无孤电子对,则为sp2杂化;
(3)根据化合物[Fe(NO)(H2O)5]SO4,配体为NO、H2O,个数分别为1、5,则配位数为6;
(4)Cu的价电子排布式为3d104s1,则Cu+排布式为[Ar]3d10,无未成对电子。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法不正确的是
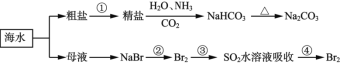
A.制取NaHCO3的反应是利用其溶解度小于NaCl
B.侯氏制碱应先通NH3再通CO2
C.在第②、③、④步骤中,溴元素均被氧化
D.③④的目的是进行溴的富集
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应中,设反应物的总能量为E1,生成物的总能量为E2,
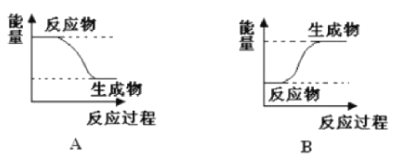
I.若E1>E2,则该反应为_____(填“放热”或“吸热”)反应。该反应可用图____(填“A”或“B”)表示。
II.若E1<E2,则该反应为______(填“放热”或“吸热”)反应。该反应可用图_____(填“A”或“B”)表示
III.下表中的数据是破坏1mol物质中的化学键所消耗的最小能量:
物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
键能(kJ/mol) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
根据上述数据回答下列问题:
(1)下列物质本身具有的能量最低的是(_____)
A.H2 B.Cl2 C.Br2 D.I2
(2)下列氢化物中最稳定的是(_____)
A.HCl B.HBr C.HI
(3)X2+H2===2HX(X代表Cl、Br、I)的反应是吸热反应还是放热反应?_______。
(4)相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是_____(填写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 反应N2(g)+3H2(g) ![]() 2NH3(g)的△H<0,△S>O
2NH3(g)的△H<0,△S>O
B. 硅太阳能电池与铜锌原电池的工作原理相同
C. NO2(g)+SO2(g) ![]() NO(g)+SO3(g),其他条件不变,加压,NO2和SO2的转化率均增大
NO(g)+SO3(g),其他条件不变,加压,NO2和SO2的转化率均增大
D. 温度不变时,在饱和Na2CO3溶液中加入少量无水碳酸钠粉末,溶液的pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2/H2O2酸性复合吸收剂可同时有效脱硫、脱硝。实验室制备少量NaClO2的装置如图所示。装置I控制温度在35~55°C,通入SO2将NaClO3还原为ClO2(沸点:11°C)。

回答下列问题:
(1)装置Ⅰ中反应的离子方程式为__________________。
(2)装置Ⅱ中反应的化学方程式为_____________________。
(3)装置用中NaOH溶液的作用是_____________。
(4)用制得的NaClO4/H2O2酸性复合吸收剂同时对NO、SO2进行氧化得到硝酸和硫酸而除去。在温度一定时,n(H2O2)/n(NaClO2)和溶液pH对脱硫、脱硝的影响如图所示:

①从图1和图2中可知脱硫、脱硝的最佳条件是n(H2O2)/n(NaClO2)=________________。pH在_________________之间。
②图2中SO2的去除率随pH的增大而增大,而NO的去除率在pH>5.5时反而减小。NO去除率减小的可能原因是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬、钼(Mo)、钨(W)都是第ⅥB族元素,且原子序数依次增大,它们的单质和化合物在生活、生产中有广泛应用。回答下列问题:
(1)铬元素的最高化合价为_________;基态钼原子的核外电子排布类似于基态铬原子,则基态钼原子核外有_________个未成对电子;基态钨原子的核外电子排布是“洪特规则”的例外,则基态钨原子价电子层的电子排布图为____________________。
(2)钼可作有机合成的催化剂。例如,苯甲醛被还原成环己基甲醇。
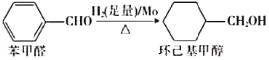
①苯甲醛分子中最多有_________________个原子共平面。
②环己基甲醇分子中采取sp3杂化的原子是_____________(写元素符号)。
(3)铬离子(Cr3+)能形成多种配合物,例如[Cr(OH)3(H2O)(H2NCH2CH2NH2)]。
①已知配合物的中心粒子的配位数指配位原子总数。上述配合物中,Cr3+的配位数为______。
②上述配合物中,非金属元素的电负性由小到大的顺序为____________。
(4)铬的一种氧化物的晶胞结构如图所示。
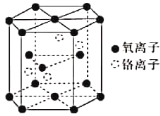
①该氧化物的化学式为____________________。
②已知六棱柱底边边长为acm,高为bcm,阿伏加德罗常数的值为NA,该晶体的密度为___________gcm-3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、P、Q为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。下列说法正确的是

A. Q的氧化物一定含有离子键和共价键 B. 最高价含氧酸的酸性:Z<Y
C. P的最低价氢化物常温常压下为液体 D. Y形成的化合物种类最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温,向20 ml0.1mol/L的CH3COOH溶液中滴加等浓度的NaOH溶液,已知由水电离出的氢氧根离子浓度c水(OH-)随滴入的NaOH溶液的体积变化如图所示,下列说法错误的是( )
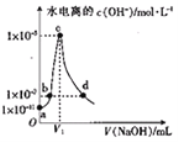
A. 常温下,醋酸的电离常数约为1×10-5
B. b、d两点溶液中均存在c(Na+)=c(CH3COO-)
C. V1=20
D. c点溶液存在:c(OH-)=c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数,下列说法正确的是
A. 1 mol硫单质在过量氧气中燃烧产生NA个SO3分子
B. 标准状况下,22.4 L SO3中含有氧原子数为3NA
C. 标准状况下,18 g H2O中含有氧原子数为NA
D. 5.4 g铝单质与足量NaOH溶液反应,转移电子数为0.6NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com