
【题目】Y(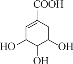 )是由中草药五倍子制备而成。
)是由中草药五倍子制备而成。
(1) Y属于_____填“无机化合物”或“有机化合物”)。
(2) Y中含氧官能团有羧基和_____(填名称)。
(3) 向Y溶液中滴入溴水,溴水褪色,说明Y中含有_____。
(4) Y具有还原性。向Y溶液中滴入几滴酸性KMnO4稀溶液,实验现象为______。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在元素周期表中的某些元素之间存在着特殊的“对角线关系”,例如:![]() 、
、![]() 、
、![]() 相似等,下列说法不正确的是
相似等,下列说法不正确的是![]()
A.氢氧化铍是两性氢氧化物
B.B、Si的电负性数值相似
C.Li和Mg的原子半径相近,且核外电子排布相近
D.Li在![]() 中燃烧能生成
中燃烧能生成![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是常温下向20.0 mL的盐酸中,逐滴加入0.10 mol·L-1 NaOH溶液时,溶液的pH随 NaOH溶液的体积V(mL)变化的曲线,根据图像所得的下列结论中正确的是

A. 原盐酸的浓度为0.10 mol·L-1
B. x的值为2.0
C. 当pH=12时,V值为20.4
D. 原盐酸的浓度为1.0 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,向等浓度的NaCl和Na2CrO4溶液中分别滴加AgNO3溶液(已知:Ag2CrO4为砖红色),平衡时溶液中相关离子浓度的关系如图所示。下列说法正确的是( )

A.L1为向Na2CrO4溶液中滴加AgNO3溶液时的离子浓度关系曲线
B.Ksp(AgCl)的数量级为10-12
C.L1和L2交点处对应的两种溶液中c(Ag+)=c(Cl-)=c(CrO42-)
D.用AgNO3标准溶液测定溶液中Cl-含量时可用Na2CrO4做指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol·L-1的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断错误的是( )

A. 三种酸的电离常数关系:KHA>KHB>KHD
B. 滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C. pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D. 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中,观察到电流计指针偏转;M棒变粗,N棒变细,由此判断下表中所列M、N、P物质,其中可以成立的是( )
M | N | P | |
A | 锌 | 铜 | 稀硫酸溶液 |
B | 铜 | 锌 | 稀盐酸溶液 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
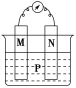
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列平衡体系中,升温或减压都能使平衡向正反应方向移动的是( )
A. N2(g)+3H2(g)![]() 2NH3(g) ΔH <0
2NH3(g) ΔH <0
B. N2(g)+O2(g)![]() 2NO(g) ΔH <0
2NO(g) ΔH <0
C. C(s)+2H2O(g)![]() CO2(g)+2H2(g) ΔH >0
CO2(g)+2H2(g) ΔH >0
D. 2SO2(g)+O2(g)![]() 2SO3(g) ΔH <0
2SO3(g) ΔH <0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】F可用作丙烯酸酯橡胶的基材。以煤为原料制取F的一种合成路线如下:

(1)所用催化剂Fe在周期表的位置为:__________基态Mn原子价电子电子排布式为:__________ 。
(2)①的加工手段称为煤 __________(填“气化”“液化”或“干馏”)。
(3)②、④反应类型依次是________、________。
(4)E中所含官能团名称是________和________。
(5)C与A互为同系物,C的化学名称是________;F的结构简式为 ________。
(6)反应④的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸。发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云。根据掌握的信息分析,装箱区的危险化学品可能有钾、钠、氯酸钠、硝酸钾、烧碱,硫化碱、硅化钙、三氯乙烯、氯碘酸等。运抵区的危险化学品可能有环己胺、二甲基二硫、甲酸、硝酸铵、氰化钠、4,6-二硝基苯-邻仲丁基苯酚等。
回答下列问题:
(1)在组成NH4NO3、NaCN两种物质的元素中第一电离能最大的是__________(填元素符号),解释原因_____________________________________________
(2)二甲基二硫和甲酸中,在水中溶解度较大的是 (填名称),原因是_______;烧碱所属的晶体类型为______;硫化碱(Na2S)的S2-的基态电子排布式是____________。
(3)硝酸铵中,NO3-的立体构型为 ,中心原子的杂化轨道类型为__________
(4)1mol化合物NaCN中CN-所含的π键数为______,与CN-互为等电子体的分子有 。(CN)2又称为拟卤素,实验室可以用氰化钠、二氧化锰和浓硫酸在加热条件下制得,写成该制备的化学方程式___________。
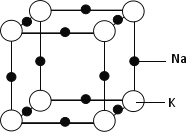
(5)钠钾合金属于金属晶体,其某种合金的晶胞结构如图所示。合金的化学式为____________;晶胞中K 原子的配位数为 ;已知金属原子半径r(Na)=186pm、r(K)=227pm,计算晶体的空间利用率 ________(列出计算式,不需要计算出结果)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com