
| A、从反应开始到平衡过程中,用C来表示该反应的平均速率为0.005 mol?L-1?min-1 | ||
B、达平衡时压强变为原来的
| ||
| C、此温度下该反应的平衡常数为0.0125 | ||
| D、若保持温度和体积不变,向平衡体系中再加入0.2 molC(S)和0.3 mol H2O(g),重新达到平衡后,H2O的转化率等于16.7% |
| (0.3-x)×18+28x+2x |
| 2 |
| 0.3×18 |
| 2 |
| (0.3-x)×18+28x+2x |
| 2 |
| 0.3×18 |
| 2 |
| 0.3-0.05+0.05+0.05 |
| 0.3 |
| 7 |
| 6 |
| ||||
|
| 0.05 |
| 0.3 |
| 1 |
| 6 |


科目:高中化学 来源: 题型:
| A、生成白色沉淀,加氨水后沉淀溶解,反应前后Ag+的浓度不变 |
| B、生成白色沉淀,加入氨水后沉淀转化成AgOH |
| C、生成白色沉淀,加入氨水后生成了更难溶的配合物Ag(NH3)2Cl? |
| D、向AgNO3溶液中直接滴加氨水,产生的现象与上述相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、依次加入过量硝酸钡和碳酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸 |
| B、依次加入过量碳酸钾和硝酸钡溶液,过滤,出去沉淀,溶液中补加适量硝酸 |
| C、依次加入过量硝酸钡和碳酸钾溶液,溶液中补加适量硝酸 |
| D、加入过量碳酸钾溶液,过滤,出去沉淀,溶液中补加适量硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、32g O2所含分子数为2NA |
| B、28g N2所含质子数为2NA |
| C、NA个CO分子和0.5mol CH4的质量之比为7:4 |
| D、14g N2中含有7NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
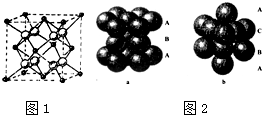
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同温同压下,原子数均为NA的氢气和氦气具有相同的体积 |
| B、常温下,42g乙烯和环丙烷的混合气体中含有的碳原子数目为3NA |
| C、标准状况下,11.2L氯仿(三氯甲烷)中含有C-Cl键的数目为1.5 NA |
| D、在反应CaO+3C=CaC2+CO中,生成1 mol CO,转移的电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
| B、萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
| C、分液操作时,分液漏斗中下层液体及上层液体均从下口放出 |
| D、蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com