
| A. | 稳定性:NH3<PH3<SiH4 | B. | 酸性:HClO4>H2SO4>H3PO4 | ||
| C. | 碱性:KOH>NaOH>Mg(OH)2 | D. | 氧化性:F2>Cl2>Br2 |
分析 A.元素的非金属性越强,对应的氢化物越稳定;
B.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
C.元素金属性越强,对应的最高价氧化物的水化物的碱性越强;
D.元素的非金属性越强,对应的单质的氧化性越强.
解答 解:A.非金属性N>P>Si,元素的非金属性越强,对应的氢化物越稳定,故A错误;
B.非金属性Cl>S>P,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故B正确;
C.金属性K>Na>Mg,元素金属性越强,对应的最高价氧化物的水化物的碱性越强,故C正确;
D.非金属性F>Cl>Br,元素的非金属性越强,对应的单质的氧化性越强,故D正确.
故选A.
点评 本题考查元素周期表和元素周期律的应用,为高频考点,把握元素的位置、性质的变化规律为解答的关键,侧重金属性、非金属性比较的考查,题目难度不大.


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:解答题
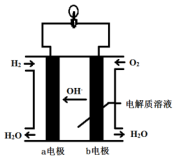 英国一家公司正在研发全球首款“充一次电,用七天”的碱性氢氧燃料手机电池.如图为碱性氢氧燃料电池结构示意图.
英国一家公司正在研发全球首款“充一次电,用七天”的碱性氢氧燃料手机电池.如图为碱性氢氧燃料电池结构示意图.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有机酸种类繁多,广泛分布于中草葯的叶、根、特别是果实中,是有机合成、工农业生产的重要原料,请回答下列有关问题:
有机酸种类繁多,广泛分布于中草葯的叶、根、特别是果实中,是有机合成、工农业生产的重要原料,请回答下列有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
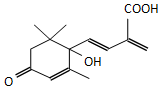 鲜花保鲜剂S-诱抗素制剂,可保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法不正确的是( )
鲜花保鲜剂S-诱抗素制剂,可保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法不正确的是( )| A. | 其分子式为C14H20O4 | |
| B. | 该物质中含有3种含氧官能团 | |
| C. | 既能发生加成反应,又能发生取代反应 | |
| D. | 既能使紫色石蕊试剂显红色,又能使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 甲 | 1000mL 0.1mol/L HCOONa溶液 |
| 乙 | 1000mL 0.1mol/L CH3COONa溶液 |
| 丙 | 1000mL含HCOONa、CH3COONa各0.05mol的溶液 |
| A. | 溶液中c(Na+):甲=乙>丙 | |
| B. | 溶液中阴、阳离子和酸分子总数:甲<丙<乙 | |
| C. | 溶液pH:甲<丙<乙 | |
| D. | 溶液中阴、阳离子总数:甲>丙>乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
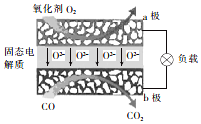 为体现节能减排的理念,中国研制出了新型固态氧化物燃料电池(SOFC),该电池的丁作原理如图所示.下列说法正确的是( )
为体现节能减排的理念,中国研制出了新型固态氧化物燃料电池(SOFC),该电池的丁作原理如图所示.下列说法正确的是( )| A. | 电子从b极经导线流向a极 | |
| B. | 正极的电极反应式为O2+4e-+2H2O═4OH- | |
| C. | 还可以选用NaOH固体作固态电解质 | |
| D. | 若反应中转移1 mol电子,则生成22.4L(标准状况)CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com