
25℃,1.01×105Pa时,反应:2N2O5(g) = 4NO2(g) +O2(g) △H = + 56.76 kJ·mol-1,能自发进行的原因是
A.是吸热反应 B.是放热反应 C.是熵减少的反应 D.熵增大效应大于能量效应
科目:高中化学 来源:2017届黑龙江哈尔滨三中高三上验收考试三化学卷(解析版) 题型:填空题
A、B、C、D、E、F、G和J是元素周期表中前20号的主族元素,其原子序数依次增大。已知:
①A和D为同主族元素,且A的单质是最轻的气体;
②B元素最高价氧化物的水化物与其气态氢化物反应生成盐;
③F、G相邻,C的核电荷数是F核外电子数的一半,F与J可形成离子化合物J2F;
④E元素是地壳中含量最多的金属元素。
完成下列填空:
(1)ACD三种元素共同形成的化合物的电子式为____________,其微粒间存在的化学键有____________;将这种化合物滴入EG两种元素形成的化合物溶液中,直至过量,总反应的离子方程式为__________________。
(2)E元素位于周期表的第____________周期____________族。
(3)铜与B元素最高价氧化物的水化物的浓溶液反应的离子方程式为_________________。
(4)F、G分别与A形成的化合物,还原性强的是_______(填写相应的化学式)。
(5)F简单阴离子的结构示意图_______,且F、G、J简单离子的半径由大至小的顺序是_______(填写相应离子符号)
(6)实验室制取单质G的化学方程式为____________________________,
比较F、G的最高价氧化物的水化物的酸性(填写相应化学式)_______>_______。
(7)一种燃料电池,以铂为电极插入KOH溶液中,分别向两极通入A单质和C单质。通入C单质的一极是_______极,电极反应式为:________________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上期中化学试卷(解析版) 题型:选择题
下列说法正确的是
A. 配制一定浓度的稀硫酸,用量筒量取浓硫酸后,未将蒸馏水洗涤量筒后的洗涤液转移至容瓶中,使配制的溶液浓度偏小
B. pH试纸使用时不需要润湿,红色石蕊试纸检测气体时也不需要润湿
C. 蒸发时将蒸发皿放置在铁架台的铁圈上,并加垫石棉网加热
D. 蒸馏实验中,忘记加沸石,可以先停止加热,待溶液冷却后加入沸石,再继续加热蒸馏
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高二上期中化学试卷(解析版) 题型:选择题
下列有关电解质溶液中微粒的物质的量的浓度关系正确的是
A.在0.1mol·L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
B.在0.1mol·L-1Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H2CO3)+ c(H+)
C.向0.2 mol·L-1NaHCO3溶液中加入等体积0.1mol·L-1NaOH溶液:
c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
D.常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1mol·L-1]:
c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高二上期中化学试卷(解析版) 题型:选择题
某温度下,在固定容积的容器中,可逆反应A(g)+3B(g)  2C(g)达到平衡时,各物质的物质的量之比为n(A) : n(B): n(C)=2 : 2 : 1••保持温度不变,以2 : 2 : 1的物质的量之比再充入A、B、C,则
2C(g)达到平衡时,各物质的物质的量之比为n(A) : n(B): n(C)=2 : 2 : 1••保持温度不变,以2 : 2 : 1的物质的量之比再充入A、B、C,则
A.平衡不移动
B.再达平衡时,n(A) : n(B) : n(C)仍为2 : 2 : 1
C.再达平衡时,C的体积分数增大
D.再达平衡时,正反应速率增大,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高二上期中化学试卷(解析版) 题型:选择题
分子式为C5H7C1的有机物,其结构不可能是
A.只含有1个碳碳双键的链状有机物
B.含2个碳碳双键的链状有机物
C.含1个碳碳双键的环状有机物
D.含一个碳碳叁键的链状有机物
查看答案和解析>>
科目:高中化学 来源:2017届安徽师大附中高三上新课标模拟化学卷(解析版) 题型:填空题
合成氨是最重要的化工生产之一,回答下列问题:
I.氢气通常用生产水煤气的方法制得。其中CO(g)+H2O(g)  CO2(g) + H2(g) △H<0,在 850℃时,平衡常数 K=1。
CO2(g) + H2(g) △H<0,在 850℃时,平衡常数 K=1。
(1)若升高温度到950℃时,达到平衡时K_________1(填“>”“<”或“ = ”)
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0mol CO、3.0mol H2O、1.0mol CO2和xrnolH2,则:
①当x= 5.0时,上述平衡向_________(填正反应或逆反应)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是_____________。
(3)在850℃时,若设x=5.0mol和x= 6.0mol,其它物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a_______b(填“大于”、“小于”或“等于”)。
II.氨和尿素【CO(NH2)2】溶液都可以吸收硝酸工业尾气中的NO、NO2,将其转化为N2。
(4)尿素与NO、NO2三者等物质的最反应为:CO(NH2)2+NO+NO2=CO2+2N2+2H2O
该反应中的氧化剂为________(写化学式)。
若反应生成标况下N2 33.6L,则转移电子的数目为___________。
(5)已知:N2(g)+O2(g)=2NO(g)△H1=akJ ·mol-1
N2(g)+3H2(g) = 2NH3(g) △H2 = bkJ • mol-1
2H2(g) +O2(g) = 2H2O(g) △H3=ckJ • mol-1
则4NO(g)+4NH3(g)+O2(g)=4N2(g)+6H2O(g) △H=__________。
III.(6)合成氨盐也是氨的重要用途,测定其中的含氮量可以采用“甲醛法”。即4NH4++6HCHO (CH2)6N4+4H++6H2O。 现有一种纯净的铵盐,可能是硝酸铵、硫酸铵或碳酸铵中的一种。称取2g该铵盐溶于水,加入足量的甲醛溶液后,再加人水配成100mL溶液,取出10mL,滴入酚酞后再逐滴滴入0.lmol/L的NaOH溶液,当滴到25mL时溶液呈粉红色,且在半分钟内不褪色,则该铵盐中氮的质量分数是_________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁东北育才学校高二上阶段考二化学卷(解析版) 题型:选择题
在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。
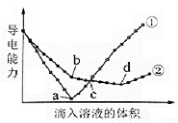
下列分析不正确的是
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH–
C.c点,两溶液中含有相同量的OH–
D.a、d两点对应的溶液均显中性
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高一上月考二化学试卷(解析版) 题型:填空题
由于燃料电池汽车,尤其氢燃料电池汽车可以实现零污染排放,驱动系统几乎无噪音,且氢能取之不尽、用之不竭,燃料电池汽车成为近年来汽车企业关注的焦点。为了获得竞争优势,各国纷纷出台政策,加速推进燃料电池关键技术的研发。燃料电池的燃料选择有氢气、甲醇等。
(1)二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气合成为甲醇,甲醇是汽车燃料电池的重要燃料。已知氢气、甲醇燃烧的热化学方程式如下:
2H2(g)+O2(g)=2H2O (l) ΔH=-285
(l) ΔH=-285 kJ·mol-1①
kJ·mol-1①
CH3OH(l)+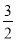 O2(g)=CO2(g)+2H2O(l) ΔH=-726.0 kJ·mol-1②
O2(g)=CO2(g)+2H2O(l) ΔH=-726.0 kJ·mol-1②
写出二氧化碳与氢气合成甲醇液体的热化学方程式:________________________。
(2)有科技工作者利用稀土金属氧化物作为固体电解质制造出了甲醇—空气燃料电池。这种稀土金属氧化物在高温下能传导O2-。
①这个电池的正极发生的反应是______________;负极发生的反应是________________。
②在稀土氧化物的固体电解质中,O2-的移动方向是______________。
③甲醇可以在内燃机中燃烧直接产生动力推动机动车运行,而科技工作者要花费大量的精力研究甲醇燃料汽车。主要原因是_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com