
下列对晶体类型判断正确的是( )
| 选项 | Na2B2O7 | CaF2 | H3BO3 | NH3 |
| A | 原子晶体 | 金属晶体 | 原子晶体 | 分子晶体 |
| B | 离子晶体 | 分子晶体 | 离子晶体 | 分子晶体 |
| C | 离子晶体 | 离子晶体 | 分子晶体 | 分子晶体 |
| D | 分子晶体 | 离子晶体 | 分子晶体 | 离子晶体 |
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
下列叙述Ⅰ和叙述Ⅱ均正确且有因果关系的是( )
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | H2有还原性,浓硫酸有强氧化性 | 不能用浓硫酸干燥H2 |
| B | CuS难溶于水和硫酸 | 反应:H2S+CuSO4===CuS↓+H2SO4可以发生 |
| C | 浓H2SO4有吸水性 | 浓H2SO4可用于干燥氨气 |
| D | SO2具有酸性和漂白性 | 往紫色石蕊溶液中通入SO2,溶液先变红再褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
判断正误,正确的打“√”,错误的打“×”
(1)在晶体中只要有阴离子就一定有阳离子( )
(2)在晶体中只要有阳离子就一定有阴离子( )
(3)原子晶体的熔点一定比金属晶体的高( )
(4)分子晶体的熔点一定比金属晶体的低( )
(5)离子晶体一定都含有金属元素( )
(6)金属元素和非金属元素组成的晶体不一定是离子晶体( )
查看答案和解析>>
科目:高中化学 来源: 题型:
用晶体的X射线衍射法对Cu的测定得到以下结果:Cu的晶胞为

面心立方最密堆积(如右图),已知该晶体的密度为9.00 g·cm-3,晶胞中该原子的配位数为________;Cu的原子半径为________cm(阿伏加德罗常数为NA,要求列式计算)。
查看答案和解析>>
科目:高中化学 来源: 题型:
Z基态原子的M层与K层电子数相等,它与某元素形成的化合物的晶胞如下图所示,晶胞中阴离子和阳离子的个数之比是___________________________。
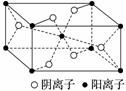
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.由于铵盐中是有离子键构成的,因而化学性质相当稳定
B.分子晶体中都存在分子间作用力,但可能不存在共价键
C.在常见的四种晶体类型中,都有“原子(离子)半径越大,物质熔点越低”的规律
D.常温下为气态或液态的物质,其固态时一定会形成分子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)氯酸钾熔化,粒子间克服了________的作用力;二氧化硅熔化,粒子间克服了________的作用力;碘的升华,粒子间克服了________的作用力。三种晶体的熔点由高到低的顺序是____________(填化学式)。
(2)下列六种晶体:①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,它们的熔点从低到高的顺序为________(填序号)。
(3)在H2、(NH4)2SO4、SiC、CO2、HF中,由极性键形成的非极性分子是________,由非极性键形成的非极性分子是________,能形成分子晶体的物质是________,含有氢键的晶体的化学式是________________________,属于离子晶体的是____________________,属于原子晶体的是____________________,五种物质的熔点由高到低的顺序是________________。
(4)A、B、C、D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3 500℃
试推断它们的晶体类型:
A.________________;B.________________;
C.________________;D.________________。
(5)相同压强下,部分元素氟化物的熔点见下表:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/℃ | 1 266 | 1 534 | 183 |
试解释上表中氟化物熔点差异的原因:_____________________________________。
(6)镍粉在CO中低温加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。150 ℃时,Ni(CO)4分解为Ni和CO。Ni(CO)是________晶体,Ni(CO)4易溶于下列________(填序号)
a.水 b.四氯化碳 c.苯 d.硫酸镍溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)质子数为35、中子数为45的溴原子: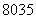 Br( )
Br( )
(2014·江苏,2B)
(2)硫离子的结构示意图: ( )
( )
(2014·江苏,2C)
(3)核外电子排布相同的微粒化学性质也相同( )
(2014·山东理综,8B)
(4)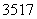 Cl与
Cl与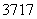 Cl得电子能力相同( )
Cl得电子能力相同( )
(2014·山东理综,8D)
(5)氯原子的结构示意图: ( )
( )
(2013·江苏,2C)
(6)中子数为146、质子数为92的铀(U)原子: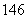 92U( )
92U( )
(2013·江苏,2D)
(7)原子核内有18个中子的氯原子: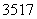 Cl( )
Cl( )
(2012·海南,9D)
(8)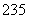 92U和
92U和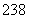 92U是中子数不同质子数相同的同种核素( )
92U是中子数不同质子数相同的同种核素( )
(2012·天津理综,3C)

(9)元素周期表中铋元素的数据见右图,则:
①Bi元素的质量数是209( )
②Bi元素的相对原子质量是209.0( )
(2012·上海,6改编)
查看答案和解析>>
科目:高中化学 来源: 题型:
NA代表阿伏加德罗常数,在含4 g NaOH溶质的溶液中通入一定量的CO2,将溶液蒸干并灼烧,最后得到的固体可能是( )
A.0.1NA的NaHCO3
B.0.05NA Na2CO3
C.0.05NA~0.1NA Na2CO3和NaHCO3混合物
D.0.1NA的NaHCO3和NaOH混合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com