
| A. | 金属钠长期露置在空气中,最终生成碳酸钠,中间有Na2O2生成 | |
| B. | 比较去锈的铁钉和去锈的绕有细铜丝的铁钉与同浓度盐酸反应速率快慢时,可以加几滴KSCN溶液,观察铁钉周围出现出现血红色现象的快慢 | |
| C. | 原电池的制作:用导线把二极管和锌片、铜片连接起来,锌与铜之间隔一块薄海绵放入稀H2SO4 溶液,二极管发光但很快变暗,若再加入H2O2瞬间又变亮且能持续较长时间 | |
| D. | 在蔗糖中滴加浓硫酸产生的气体,能使酸性KMnO4溶液褪色,说明该气体具有漂白性 |
分析 A.常温下,钠与氧气反应生成氧化钠;
B.铁与盐酸反应生成亚铁离子;
C.锌、铜原电池中,锌为负极,加入过氧化氢,可氧化锌;
D.生成气体为二氧化硫,具有还原性.
解答 解:A.常温下,钠与氧气反应生成氧化钠,中间没有过氧化钠生成,故A错误;
B.铁与盐酸反应生成亚铁离子,加入KSCN没有明显现象,不能比较反应快慢,故B错误;
C.锌、铜原电池中,锌为负极,加入硫酸,负极生成氢气,硫酸的浓度较小,二极管发光但很快变暗,再加入过氧化氢,可氧化锌,继续形成原电池反应,故C正确;
D.生成气体为二氧化硫,具有还原性,与高锰酸钾发生氧化还原反应,故D错误.
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质性质检验、原电池等,侧重实验基本操作和实验原理的考查,注意装置的作用及实验的操作性、评价性分析,题目难度不大.


 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:解答题
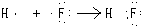 .
. ,写出A、B两元素按1:1原子个数比形成化合物的电子式
,写出A、B两元素按1:1原子个数比形成化合物的电子式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用热的纯碱溶液除去矿物油污渍 | |
| B. | 盐析可提蛋白质并保持其生理活性 | |
| C. | 单质硅不仅用于制造计算机芯片,也是生产太阳能电池的材料 | |
| D. | 食品脱氧剂(含铁粉、氯化钠、炭粉等)的脱氧原理与钢铁的吸氧腐蚀相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 阳离子 | K+、NH4+、Fe3+、Ba2+ |
| 阴离子 | Cl-、Br-、CO32-、HCO3-、SO32-、SO42- |
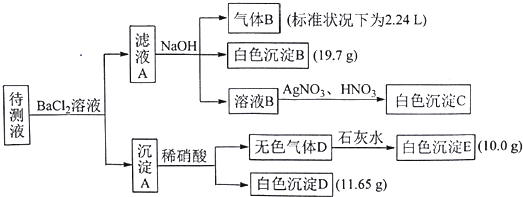
| A. | 向溶液B中加AgNO3与HNO3的操作不是多余的,待测液除含有Na+外,一定含有K+、NH4+、CO32-、HCO3-且c(K+)≥0.1mol•L-1 | |
| B. | 生成白色沉淀B的离子方程式为:Ba2++HCO3-+OH-═BaCO3↓+H2O | |
| C. | 若无色气体D是单一气体,则原溶液中c(SO42-)=0.05 mol•L-1 | |
| D. | 若无色气体D是混合气体,则沉淀A的成分是BaCO3、BaSO3、BaSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取少量含稀硫酸的淀粉水解液于试管中,加入过量的NaOH溶液,再滴加少量碘水以检验淀粉是否完全水解 | |
| B. | 向AlCl3溶液中逐滴滴加NaOH溶液至过量,可证明Al(OH)3是两性氢氧化物 | |
| C. | 酸碱中和滴定时,用强酸滴定强碱通常滴加2~3滴甲基橙做指示剂,若甲基橙加入过多对实验无影响 | |
| D. | 在砂纸打磨过的铁片上滴几滴含酚酞的饱和食盐水,静置1~2 min,会观察到在液滴的边缘位置先出现红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2:7 | B. | 7:15 | C. | 3:8 | D. | 1:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S在过量氧气中燃烧生成SO3 | |
| B. | 浓硫酸具有吸水性,但不可干燥氨气和二氧化硫 | |
| C. | NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中 | |
| D. | 锌与足量稀硫酸反应,滴入几滴硫酸铜溶液,可使反应速率加快,又不影响生成气体的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的MgCl2、Ba(OH)2和HCl溶液混合:Mg2++2OH-═Mg(OH)2↓ | |
| B. | 用两个铜电极电解CuSO4 溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$ 2Cu↓+O2↑+4H+ | |
| C. | 硫酸氢钠溶液与氢氧化钡溶液恰好反应呈中性:H++SO42-+Ba2++OH-═H2O+BaSO4↓ | |
| D. | 向含有0.1 mol溶质的硫酸亚铁稀溶液中加入7.8 g Na2O2:4Na2O2+4Fe2++6H2O═4Fe(OH)3+8Na++O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,1LpH=13的NaOH溶液中,由水电离的OH-数目为0.1NA | |
| B. | 0.1mol${\;}_{38}^{90}$Sr原子中含中子数为3.8NA | |
| C. | 50mL12mol/L的盐酸与足量MnO2共热,转移电子数为0.3NA | |
| D. | 2.0gH218O与D216O的混合物中所含中子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com