
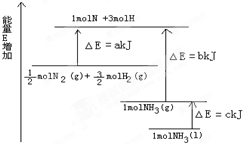
 氨在工农业生产中应用广泛.在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如下:
氨在工农业生产中应用广泛.在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如下:| 温度/℃ | 200 | 300 | 400 | 500 | 600 |
| 氨含量/% | 89.9 | 71.0 | 47.0 | 26.4 | 13.8 |
| 2 |
| 3 |
| 2 |
| 3 |
| 3 |
| 2 |
| c2(NH3) |
| c(N2)c3(H2) |
| 12 |
| 0.5×1.53 |
| 16 |
| 27 |
| 16 |
| 27 |
| 2 |
| 3 |
| 3 |
| 2 |
| 3 |
| 2 |
| 0.5mol |
| 1mol |


科目:高中化学 来源: 题型:
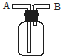 将晶体X加热分解,可得A、B、D、E、F和水六种产物,其中A、B、D都是中学化学中常见的氧化物,气体E是单质F所含元素的氢化物.
将晶体X加热分解,可得A、B、D、E、F和水六种产物,其中A、B、D都是中学化学中常见的氧化物,气体E是单质F所含元素的氢化物.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
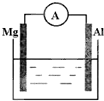 如图所示,组成一个原电池.
如图所示,组成一个原电池.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化镁与稀硫酸反应 H++OH-=H2O |
| B、钠与水的反应 Na+2H2O=Na++2OH-+H2↑ |
| C、碳酸钙溶于醋酸CaCO3+2H+=Ca2++CO2↑+H2O |
| D、用氢氧化钠溶液吸收少量二氧化碳2OH-+CO2=CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠块一直浮在乙醇液面上 |
| B、钠块很快熔化成光亮的钠球 |
| C、比钠与水的反应激烈得多 |
| D、钠块表面有气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、正极附近SO42-的浓度逐渐增大 |
| B、负极附近SO42-的浓度逐渐减小 |
| C、负极附近SO42-的浓度逐渐增大 |
| D、正极附近SO42-的浓度基本不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com