
| NH3•H2O | 2×10-5 |
| HNO2 | 7×10-4 |
| HClO | 3×10-8 |
| H2CO3 | K1=4×10-7 K2=4×10-11 |
分析 (1)相同温度下等浓度的NH4NO3和NH4NO2两份溶液,测得NH4NO2溶液中c(NH4+)较小是因为NO2-是弱酸阴离子水解显碱性,铵根离子水解显酸性,二者水解相互促进,NH3•H2O电离平衡常数小于HNO2,铵根离子水解程度大于亚硝酸根离子水解程度,溶液显酸性,亚硝酸铵溶液中水解平衡:NO2-+H2O?HNO2+OH-,依据水解平衡常数表达式,分子和分母都乘以氢离子浓度得到水解平衡常数Kh=$\frac{c(O{H}^{-})c(HN{O}_{2})}{c(N{{O}_{2}}^{-})}$=$\frac{c(O{H}^{-})c(HN{O}_{2})}{c(N{{O}_{2}}^{-})}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{Kw}{Ka}$;
(2)根据盐类水解规律,已知NH3.H2O的电离平衡常数K=1.75×10-5,H2CO3的电离平衡常数K1=4.4×10-7,K2=4.7×10-11,越弱越水解判断;反应NH3•H2O+H2CO3?NH4++HCO3-+H2O的平衡常数K=$\frac{c(N{{H}_{4}}^{+})c(HC{{O}_{3}}^{-})}{c(N{H}_{3}•{H}_{2}O)c({H}_{2}C{O}_{3})}$=$\frac{c(N{{H}_{4}}^{+})c(HC{{O}_{3}}^{-})}{c(N{H}_{3}•{H}_{2}O)c({H}_{2}C{O}_{3})}$×$\frac{c({H}^{+})c(O{H}^{-})}{c({H}^{+})c(O{H}^{-})}$=$\frac{Kb×K{a}_{1}}{c({H}^{+})c(O{H}^{-})}$进行计算;
(3)酸性强弱HClO>HCO3-,根据强酸制取弱酸知,二者反应生成碳酸氢钠和次氯酸;
解答 解:(1)相同温度下等浓度的NH4NO3和NH4NO2两份溶液,测得NH4NO2溶液中c(NH4+)较小,是因为NO2-是弱酸阴离子水解显碱性,铵根离子水解显酸性,二者水解相互促进;NH3•H2O电离平衡常数小于HNO2,铵根离子水解程度大于亚硝酸根离子水解程度,溶液显酸性,溶液中离子浓度大小为:c(NO2-)>c(NH4+)>c(H+)>c(OH-);依据NO2-+H2O?HNO2+OH-,水解平衡常数表达式Kh=$\frac{c(O{H}^{-})c(HN{O}_{2})}{c(N{{O}_{2}}^{-})}$=$\frac{c(O{H}^{-})c(HN{O}_{2})}{c(N{{O}_{2}}^{-})}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{Kw}{Ka}$=$\frac{1{0}^{-14}}{7×1{0}^{-4}}$=1.4×10-11;
故答案为:NO2-水解显碱性,对铵根离子水解起到促进作用,c(NO2-)>c(NH4+)>c(H+)>c(OH-);1.4×10-11;
(2)根据盐类水解规律,已知NH3.H2O的电离平衡常数K=1.75×10-5,H2CO3的电离平衡常数K1=4.4×10-7,K2=4.7×10-11,所以碳酸氢根的水解程度更大,所以NH4HCO3显碱性,PH>7,反应NH4++HCO3-+H2O═NH3.H2O+H2CO3的平衡常数K=$\frac{c(N{{H}_{4}}^{+})c(HC{{O}_{3}}^{-})}{c(N{H}_{3}•{H}_{2}O)c({H}_{2}C{O}_{3})}$=$\frac{c(N{{H}_{4}}^{+})c(HC{{O}_{3}}^{-})}{c(N{H}_{3}•{H}_{2}O)c({H}_{2}C{O}_{3})}$×$\frac{c({H}^{+})c(O{H}^{-})}{c({H}^{+})c(O{H}^{-})}$=$\frac{Kb×K{a}_{1}}{c({H}^{+})c(O{H}^{-})}$=$\frac{2×1{0}^{-5}×4×1{0}^{-7}}{1{0}^{-14}}$=800,
故答案为:>;800;
(3)酸性强弱HClO>HCO3-,根据强酸制取弱酸知,二者反应生成碳酸氢钠和次氯酸,离子方程式为ClO-+CO2+H2O═HClO+HCO3-,
故答案为:ClO-+CO2+H2O═HCO3-+HClO.
点评 本题考查了弱电解质电离平衡、电离平衡常数计算、酸性强弱和盐类水解原理分析、离子方程式等,掌握基础是解题关键,题目难度中等.


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | NaCL(aq)$\stackrel{CO_{2}}{→}$NaHCO3(s)$\stackrel{△}{→}$NaCO3(s) | |
| B. | FeSz$→_{燃烧}^{O_{2}}$SO2$\stackrel{H_{2}O}{→}$H2SO4 | |
| C. | SiO2$\stackrel{HCl(aq)}{→}$SiCl4$→_{高温}^{H_{2}}$Si | |
| D. | N2$→_{高温、高压、催化剂}^{H_{2}}$NH3$\stackrel{HCl(aq)}{→}$NH4Cl(aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合物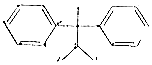 是苯的同系物 是苯的同系物 | |
| B. | 有机物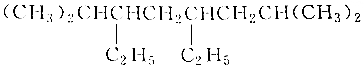 的系统名称是2-甲基-4-乙基-6-异丙基辛烷 的系统名称是2-甲基-4-乙基-6-异丙基辛烷 | |
| C. | C4H8的同分异构体只有3种 | |
| D. | 液化石油气的主要成分是烃,它是一种清洁燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温时,0.1 mol•L-1某一元酸在水中有0.1%电离,此酸的电离平衡常数约为1×10-7 | |
| B. | 反应CO(g)+3H2(g)=CH4(g)+H2O(g)一定条件下可自发进行,则该反应的△H>0 | |
| C. | 可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 | |
| D. | 为减小中和滴定误差,锥形瓶和滴定管必须洗净并润洗后才能使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
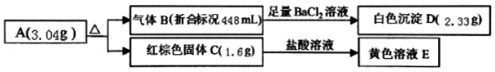
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
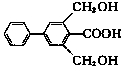 )的说法正确的是.
)的说法正确的是.| A. | 分子式为C15H19O4 | |
| B. | 苯环上的一氯代物有7种 | |
| C. | 能发生氧化反应和取代反应 | |
| D. | 1molX与足量的NaOH溶液反应,最多消耗3molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L NaHSO4溶液中:K+、AlO2-、Cl-、CH3COO- | |
| B. | 0.1mol/L NaHCO3溶液中:Al3+、Ca2+、SO42-、NO3- | |
| C. | 0.1mol/L FeCl3溶液中:NH4+、NO3-、Na+、SO42 | |
| D. | 0.1mol/L H2O2溶液中:Na+、K+、SO42-、I- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com