
| 实验及试剂 | 编号 | 无色NaClO3溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
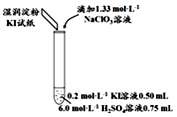 | 1 | 0.05mL | 浅黄色 | 无色 |
| 2 | 0.20mL | 深黄色 | 无色 | |
| 3 | 0.25mL | 浅黄色 | 蓝色 | |
| 4 | 0.30mL | 无色 | 蓝色 |
| 编号 | 6.0mol•L-1 H2SO4 溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
| 5 | 0.25mL | 浅黄色 | 无色 |
| 6 | 0.85mL | 无色 | 蓝色 |
分析 (1)加入0.20mL NaClO3后,溶液颜色变为深黄色,淀粉KI试纸颜色变蓝色,说明氯酸根离子具有氧化性能氧化碘离子为单质碘;
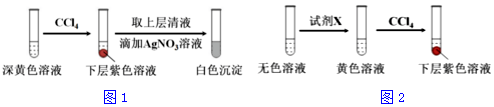
(2)①加入0.30 mLNaClO3后,溶液为无色,NaClO3溶液用量增加导致溶液褪色的原因是过量的NaClO3溶液与(1)中的反应产物继续反应,同时生成Cl2;取少量实验4中的无色溶液进行如图实验,进一步佐证其中含有IO3-,
②将实验4中的湿润淀粉KI试纸替换为湿润的淀粉试纸,再滴加0.30mL 1.33mol•L-1NaClO3溶液后,发现湿润的淀粉试纸没有明显变化,说明无碘单质生成,NaClO3溶液用量增加导致溶液褪色的原因是过量的NaClO3溶液与(1)中的反应产物继续反应,同时生成Cl2;说明是氯气的氧化性以后碘离子生成了碘单质;NaClO3溶液用量增加导致溶液褪色的原因是氯酸根离子以后碘单质为碘酸根离子;
(3)①对比实验5和6,硫酸用量不同试管中溶液颜色不同说明氢离子浓度不同氯酸根离子以后碘离子产物不同;
②实验6的现象是氯酸根离子以后碘离子生成碘酸根,通式生成氯气能使湿润的淀粉KI试纸变蓝色.
解答 解:(1)加入0.20mL NaClO3后,溶液颜色变为深黄色,淀粉KI试纸颜色变蓝色,说明氯酸根离子具有氧化性能氧化碘离子为单质碘,反应的离子方程式为:ClO3-+6I-+6H+═Cl-+3I2+3H2O,
故答案为:ClO3-+6I-+6H+═Cl-+3I2+3H2O;
(2)①取少量实验4中的无色溶液进行如图实验,无色溶液中加入试剂X变为黄色,加入四氯化碳萃取得到下层紫红色,说明生成了碘单质,加入的试剂具有还原性,能和碘酸根离子发生氧化还原反应生成碘单质,选择c选项的NaHSO3溶液,a选项含碘单质不能验证,b为高锰酸钾溶液具有氧化性,不符合要求,进一步佐证其中含有IO3-,所选试剂为c,
故答案为:c;
②将实验4中的湿润淀粉KI试纸替换为湿润的淀粉试纸,再滴加0.30mL 1.33mol•L-1NaClO3溶液后,发现湿润的淀粉试纸没有明显变化,说明无碘单质生成,排除易升华的I2对湿润淀粉KI试纸检验Cl2的干扰,NaClO3溶液用量增加导致溶液褪色的原因是过量的NaClO3溶液与(1)中的反应产物继续反应,同时生成Cl2;说明是氯气的氧化性以后碘离子生成了碘单质;NaClO3溶液用量增加导致溶液褪色的原因是氯酸根离子以后碘单质为碘酸根离子,反应的离子方程式为:2ClO3-+I2═Cl2↑+2IO3-,
故答案为:排除易升华的I2对湿润淀粉KI试纸检验Cl2的干扰;2ClO3-+I2═Cl2↑+2IO3-;
(3)①对比实验5和6,硫酸用量不同试管中溶液颜色不同说明氢离子浓度不同氯酸根离子以后碘离子产物不同,获得的结论是ClO3-和I-的反应规律与H+(或H2SO4)的用量有关,
故答案为:ClO3-和I-的反应规律与H+(或H2SO4)的用量有关;
②实验6的现象是氯酸根离子以后碘离子生成碘酸根,通式生成氯气能使湿润的淀粉KI试纸变蓝色,反应的离子方程式为:6ClO3-+5I-+6H+═3Cl2↑+5IO3-+3H2O,
故答案为:6ClO3-+5I-+6H+═3Cl2↑+5IO3-+3H2O.
点评 本题考查了物质性质的实验验证、物质反应的现象、物质用量不同反应产物不同发生反应的现象不同,注意反应用量的分析判断,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol O3与11.2 L O2所含的分子数一定相等 | |
| B. | 标准状况下,11.2 L由N2与CO组成的混合气体含有的原子数目为NA | |
| C. | 标准状况下,22.4 L的CCl4中含有的CCl4分子数为NA | |
| D. | 常温常压下,22.4 L的NO2和CO2混合气体含有2NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 溶液中OH-向电极a移动 | |
| B. | O2在电极b上发生还原反应 | |
| C. | 负极的电极反应式为:2NH3-6e-+6OH-=N2+6H2O | |
| D. | 反应消耗的NH3与O2的物质的量之比为4:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 现象 | 结论 | |
| A | 在试管中加入35mLNaAlO2溶液,再加入 过量稀盐酸,边加边振荡 | 溶液生成白色沉淀 | 制得A1(OH)3胶体 |
| B | 向两支盛有KI3溶液的试管中,分别滴加淀粉溶液和AgNO3溶液 | 前者溶液变蓝,后者有黄色沉淀 | KI3溶液中存在平衡:I3-?I2+I- |
| C | 将浓硫酸和乙醇混合加热,产生气体通入酸性KMnO4溶液 | 酸性KMnO4溶液褪色 | 产生了乙烯 |
| D | 淀粉溶液中加入几滴稀硫酸,水浴加热几分钟,再加入新制银氨溶液,水浴加热 | 无明显现象 | 淀粉未发生水解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z的浓度可能为0.3mol/L | |
| B. | 平衡时X2、Y2的转化率相等 | |
| C. | 平衡时,Y2和Z的生成速率之比为2:1 | |
| D. | 若平衡后再改变外界条件,升高温度,则反应的平衡常数将变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④>②>③>① | B. | ④>③>②>① | C. | ②>③>①>④ | D. | ③>②>①>④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8 | B. | 9 | C. | 10 | D. | 12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ③④ | D. | ①③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com