
【题目】下列说法中正确的是( )
A.周期表是按原子量逐渐增大的顺序从左到右排列的
B.最外层电子数相同的元素都是同一族
C.同族元素的最外层电子数一定相同
D.同周期元素的电子层数相同
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列实验过程中产生的现象与对应的图形相符合的是( )
A. NaHSO3粉末加入HNO3溶液中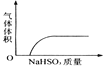 B. H2S气体通入氯水中
B. H2S气体通入氯水中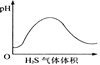
C. NaOH溶液滴入Ba(HCO3)2溶液中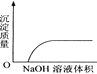 D. CO2通入澄清石灰水中
D. CO2通入澄清石灰水中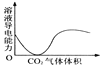
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。

图中:①为氯气发生装置;②的试管里盛有15 mL 30%KOH溶液,并置于热水浴中;③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过________(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有________(填写下列编号字母)的净化装置。
A.碱石灰 B.饱和食盐水
C.浓硫酸 D.饱和碳酸氢钠溶液
(2)本实验中制取次氯酸钠的离子方程式是_______________________。
(3)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
实验现象 | 原因 |
溶液最初从紫色逐渐变为___________色 | 氯气与水反应生成的H+使石蕊变色 |
随后溶液逐渐变为无色 | ___________________________ |
然后溶液从无色逐渐变为_________色 | ____________________________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,回答下列问题:
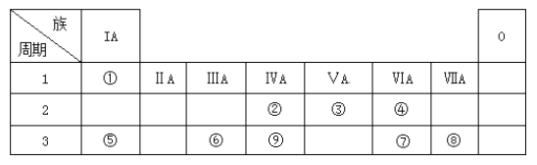
(1)第三周期中元素非金属性最强的元素的原子结构示意图为__________。
(2)②③⑨最高价氧化物对应水化物酸性强弱顺序为(填化学式)_____________。
(3)用电子式表示④的氢化物的形成过程_________________________。
(4)下列可以判断⑤和⑥金属性强弱的是__________。
a. ⑤单质的熔点比⑥单质低
b. ⑤的化合价比⑥低
c. ⑤单质与水反应比单质⑥剧烈
d. ⑤最高价氧化物的水化物的碱性比⑥强
(5)由表中①、③、④、⑥、⑧元素形成的常见物质Z、M、N可发生以下反应:
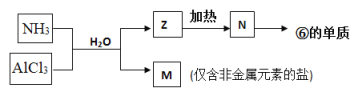
a. M中所含的化学键种类为(若含共价键,请标明极性或非极性)_________。
b. N→⑥的单质的化学方程式_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气在工农业生产中有重要应用。
(1)写出工业合成氨的化学方程式_____。
(2)某化学实验小组同学利用以下装置制备氨,并探究氨的性质(部分仪器已略去)。
请回答:

①实验室制备氨的化学方程式为_____。
②用装置B收集氨时,氨的进气口是____(选填“a”或“b”)。打开装置B中的活塞c,若观察到烧瓶内产生了红色喷泉,则说明氨具有的性质是______,____。
③向C中NaOH固体上滴几滴浓氨水,迅速盖上盖,观察现象。浓盐酸液滴附近会出现白烟,发生反应的化学方程式为_____。FeSO4液滴中先出现灰绿色沉淀,过一段时间后变成红褐色,发生的反应包括Fe2++2NH3·H2O===Fe(OH)2↓+2NH4+和_____。
④为防止环境污染,以下装置(盛放的液体均为水)可用于吸收多余氨的是____(填序号)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D 4种短周期元素的原子序数依次增大。A、D同族;B、C同周期。A、B组成的化合物甲为气态,其中A、B原子个数之比为4:1。常温下,由A、C组成的两种化合物乙和丙都为液态,乙中A、C原子个数比为1:1;丙中A、C原子个数比为2:1。由D和C组成的两种化合物丁和戊都为固态,丁中D、C原子个数之比为1:1;戊中D、C个数比为2:1。B元素的最高价氧化物跟丁能发生化学反应,生成物为两种,其中一种为C的单质。
(1)写出对应物质的化学式①乙_______;②丁_______。
(2)B元素的最高价氧化物跟丁反应的化学方程式_______。
(3)写出下列物质的电子式①甲_______;②戊_______。
(4)A、B、C、D4种原子的半径由大到小顺序______(填元素符号)。
(5)由A、B、C、D4种原子组成的既含离子键又含共价键的物质的化学式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)现有如下两个反应:A.NaOH+HCl=NaCl+H2O;B.Zn+H2SO4=ZnSO4+H2↑。上述反应中能设计成原电池的是______(填字母代号),负极Zn发生了_____反应(填“氧化”或“还原”)。
(2)将纯锌片和纯铜片按如图所示方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
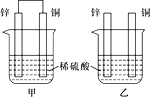
①下列说法正确的是_______(填字母代号)。
A.甲、乙均为化学能转变为电能的装置 B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少 D.两烧杯中溶液的pH均增大
②在相同时间内,两烧杯中产生气泡的速度:甲______乙(填“>”、“<“或“=”)。
③请写出图中构成原电池的装置负极的电极反应式___________。
④当乙中产生1.12 L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1 L,测得溶液中c(H+)=0.1 mol·L-1(设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧。活化过程的能量变化模拟计算结果如图所示。活化氧可以快速氧化SO2。下列说法正确的是
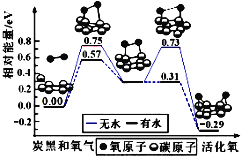
A. 每活化一个氧分子吸收0.29eV能量
B. 水可使氧分子活化反应的活化能降低0.42eV
C. 氧分子的活化是O-O的断裂与C-O键的生成过程
D. 炭黑颗粒是大气中SO2转化为SO3的催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com