
【题目】MnCO3是信息产业和机电工业的重要基础功能材料,某地有含锰矿石(主要成分是MnO2还含CaO、Al2O3、FeS等杂质),由此矿石生产MnCO3的工艺流程如下:

回答下列问题:
(1)操作Ⅰ为:___________。
(2)取溶液Ⅰ加入KSCN溶液,溶液呈血红色,试写出酸溶过程中FeS发生反应的离子方程式:
(3)调节溶液pH所用物质X最好为(_______)
A.NaOH溶液 | B.氨水 | C.MnCO3固体 | D.盐酸 |
(4)滤渣Ⅰ为___________,滤渣Ⅱ为___________。
(5)沉锰的化学方程式为:______________________。
(6)MnCO3也是制造锂离子电池的重要原料,在此电池的正极,充放电过程中发生LiMn2O4与Li1-xMn2O4之间的转化,写出该电池充电时正极发生的反应式:________。
【答案】过滤 FeS + 12H++3MnO2![]() 2Fe3++ 2S↓ + 3Mn2++ 6H2O C Al(OH)3、Fe(OH)3CaF2 MnSO4+ 2NaHCO3=MnCO3+ Na2SO4+ H2O + CO2↑ LiMn2O4 -xe- =Li1-xMn2O4+ xLi+
2Fe3++ 2S↓ + 3Mn2++ 6H2O C Al(OH)3、Fe(OH)3CaF2 MnSO4+ 2NaHCO3=MnCO3+ Na2SO4+ H2O + CO2↑ LiMn2O4 -xe- =Li1-xMn2O4+ xLi+
【解析】
(1)操作Ⅰ得到单质S沉淀,所以操作为过滤;
(2)取溶液Ⅰ加入KSCN溶液,溶液呈血红色,说明有铁离子生成,所以酸溶过程中FeS发生反应的离子方程式为FeS + 12H++3MnO2![]() 2Fe3++ 2S↓ + 3Mn2++ 6H2O;
2Fe3++ 2S↓ + 3Mn2++ 6H2O;
(3)由于不能引入杂质,则调节溶液pH所用物质X最好为 MnCO3固体,答案选C;
(4)根据表中数据可知pH=6是铁离子、铝离子完全沉淀,则滤渣Ⅰ为Al(OH)3、Fe(OH)3;滤液中还含有钙离子,则加入NaF后转化为氟化钙沉淀,即滤渣Ⅱ为CaF2;
(5)沉锰的反应物是碳酸氢钠和硫酸锰,则反应的化学方程式为MnSO4+ 2NaHCO3=MnCO3+ Na2SO4+ H2O + CO2↑;
(6)电池充电时正极发生失去电子的氧化反应,则电极反应式为LiMn2O4 -xe- =Li1-xMn2O4+ xLi+;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某实验小组对KSCN的性质进行探究,设计如下实验:
试管中试剂 | 实验 | 滴加试剂 | 现象 |
| Ⅰ | ⅰ.先加1mL 0.1mol/L FeSO4溶液 ⅱ.再加硫酸酸化的KMnO4溶液 | ⅰ.无明显现象 ⅱ.先变红,后褪色 |
Ⅱ | ⅲ.先加1mL 0.05mol/L Fe2(SO4)3溶液 ⅳ.再滴加0.5mL 0.5mol/L FeSO4溶液 | ⅲ.溶液变红 ⅳ.红色明显变浅 |
(1)SCN-存在两种结构式,分别为N≡C-S-和S=C=N-,SCN-是二者的互变异构的混合物,请写出N≡C-S-的电子式__________________________。
(2)用离子方程式表示FeSO4溶液显酸性的原因______________________。
(3)①用离子方程式表示实验Ⅰ溶液变红的原因___________。
②针对实验Ⅰ中红色褪去的原因,小组同学认为是SCN-被酸性KMnO4氧化为SO42-,并设计如图实验装置证实了猜想是成立的。其中X溶液是_______,Y溶液是_______,检验产物SO42-的操作及现象是_____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配平下列氧化还原反应方程式:
(1)______![]() ______HCl—______
______HCl—______![]() ______
______![]() ______
______![]() ______
______![]()
(2)______![]() ______
______![]() ______
______![]() ______
______![]() ______
______![]() ______H2O
______H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼元素、钙元素、铜元素在化学战有很重要的地位,单质及其化合物在工农业生产和生活中有广泛的应用.
(1)已知CaC2与水反应生成乙炔.请回答下列问题:
①将乙炔通入 [Cu(NH3)2]Cl溶液中生成Cu2C2红棕色沉淀, Cu+基态核外电子排布式为 ______ .
②CaC2中![]() 与
与![]() 互为等电子体. 1mol
互为等电子体. 1mol![]() 中含有的π键数目为 ______ .
中含有的π键数目为 ______ .
③乙炔与氢氰酸反应可得丙烯睛(CH2=CHC=N),丙烯腈分子中碳原子轨道杂化类
型是 ______ ,构成丙烯腈元素中第一电离能最大的是 ______.
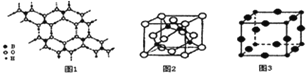
(2)硼酸 (H3BO3)是一种片层状结构的白色晶体,层内的H3BO3分子间通过氢健相连(如上图1),则1mol H3BO3的晶体中有 ______ mol氢键.硼酸溶于水生成弱电解质一水合硼酸B(OH)3·H2O,它电离生成少量[B(OH)4]-和H+,则[B(OH)4]-的空间构型为 ______
(3)某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如上图2所示![]() 黑点代表铜原子,空心圆代表M原子
黑点代表铜原子,空心圆代表M原子![]() .
.
![]() 该晶体化学式为 ______ .
该晶体化学式为 ______ .
![]() 已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于 ______
已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于 ______ ![]() 填“离子”、“共价”
填“离子”、“共价”![]() 化合物.
化合物.
(4)Cu3N的晶胞结构如右上图3, N3-的配位数为 ______ ,Cu+半径为apm,N3-半径为bpm,Cu3N的密度为 ______ g·cm-3。(阿伏加德罗常数用![]() 表示)
表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①已知白磷和氯酸溶液可发生如下反应,将该反应进行配平:
______P4+_______HClO3+_______ ______=______HCl+____H3PO4
②白磷有毒,有实验室可采用CuSO4溶液进行处理,其反应为:11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4
在该反应中30 mol CuSO4可氧化P4的物质的量是______mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家将水置于足够强的电场中,在 20℃时水分子瞬间凝固可形成“暖冰”。某兴趣小组做如图所示实验,发现烧杯中酸性 KMnO4 溶液褪色,且有气泡产生。将酸性 KMnO4 溶液换成FeCl3 溶液,烧杯中溶液颜色无变化,但有气泡产生。则下列说法中正确的是
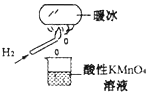
A. 20 ℃时,水凝固形成的“暖冰”所发生的变化是化学变化
B. “暖冰”是水置于足够强的电场中形成的混合物
C. 烧杯中液体为FeCl3 溶液时,产生的气体为Cl2
D. 该条件下H2 燃烧的产物中可能含有一定量的H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组微粒在指定溶液中能大量共存的是( )
A.pH=1的溶液中:CH3CH2OH、Cr2O![]() 、K+、SO
、K+、SO![]()
B.c(Ca2+)=0.1molL-1的溶液中:NH![]() 、C2O
、C2O![]() 、Cl-、Br-
、Cl-、Br-
C.加入铝粉放出大量H2的溶液:Fe2+、Na+、Cl-、NO![]()
D.含大量HCO![]() 的溶液中:C6H5O-、CO
的溶液中:C6H5O-、CO![]() 、Br-、K+
、Br-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨广泛用于生产化肥、制冷剂等方面。回答下列问题:
(1)实验室可用下图所示装置合成氨。

①合成氨时,还原铁粉的作用是________________。
②锥形瓶中盛有一定量的水,并滴有几滴酚酞试剂,反应—段时间后,锥形瓶中溶液变红,则气体X的成分为N2、水蒸气、____________和_________________。
⑵最近斯坦福大学研究人员发明了一种SUNCAT的锂循环系统,可持续合成氨,其原理如图所示。

①图中反应Ⅱ的化学方程式为____________________。
②反应Ⅲ中能量转化的方式是__________________(填“电能转变为化学能”或“化学能转变为电能”)。
(3)液氨可用作制冷剂,液氨气化时__________(填“释放”或“吸收”)能量;液氨泄漏遇明火会发生爆炸。已知部分化学键的键能数据如下表所示:
共价键 | N-H | O=O | N≡N | O-H |
键能/kJ·mol-1 | 391 | 498 | 946 | 463 |
则反应 4NH3(g)+3O2(g)=2N2(g)+6H2O(g)的反应热△H=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,某容积不变的密闭容器内存在下列平衡:2HI(g)![]() H2(g)+I2(g);则下列有关说法正确的是
H2(g)+I2(g);则下列有关说法正确的是
A. 如改变体系温度,体系颜色不一定发生变化
B. 如仅仅改变浓度这一条件,使得体系颜色加深,则上述平衡一定正移
C. 继续充入HI气体,达到平衡后, 体系颜色加深
D. 温度不变时,当体系颜色变浅,则正反应速率和逆反应速率都将减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com