
【题目】如图是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题:
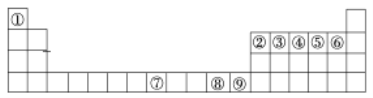
(1)根据元素原子的外围电子排布特征,元素周期表可划分为五个区域,元素⑦位于周期表的___区。
(2)写出元素③与元素⑤形成的稳定化合物的结构式______。
(3)②、⑥两元素形成的化合物其中心原子的杂化轨道类型为___。
(4)元素⑦与CO可形成X(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断该化合物晶体属于____晶体(填晶体类型)。
(5)元素⑨的离子的氢氧化物不溶于水,但可溶于氨水,该离子与NH3间结合的作用力为____。
(6)将①、⑥形成的化合物溶于水,其与水间可能存在的氢键表示为____________(写一种即可)。
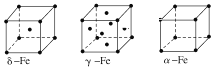
(7)金属⑦有δ、γ、α三种同素异形体,各晶胞如下图,则δ和α中原子的配位数之比为________。
【答案】d O=C=O sp2杂化 分子 配位键 F-H…F、F-H…O、O-H…F、O-H…O 4:3
【解析】
根据元素周期表可知①为H元素、②为B元素、③为C元素、④为N元素、⑤为O元素、⑥为F元素、⑦为Fe元素、⑧为Cu元素、⑨为Zn元素。
(1)元素⑦为Fe元素,位于周期表的d区,故答案为:d;
(2)元素③为C元素、元素⑤为O元素,其形成的稳定化合物为二氧化碳,结构式为:O=C=O,故答案为:O=C=O;
(3)②为B元素、⑥为F元素,两元素形成的化合物为BF3,中心原子是B,价层电子对个数=σ键+孤电子对个数=3+0=3,杂化轨道类型为:sp2杂化,故答案为:sp2杂化;
(4)元素⑦为Fe元素、与CO可形成Fe(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断该化合物晶体属于分子晶体,故答案为:分子;
(5)元素⑨Zn元素,氢氧化物为Zn(OH)2不溶于水,但可溶于氨水,Zn2+离子与NH3间结合的作用力为配位键,故答案为:配位键;
(6)①为H元素、⑥为F元素,形成的化合物为HF,溶于水,与水分子间可能存在的氢键表示为:F-H…F、F-H…O、O-H…F、O-H…O,故答案为:F-H…F、F-H…O、O-H…F、O-H…O;
(7)金属⑦为Fe,有δ、γ、α三种同素异形体,δ为体心立方,α为简单立方,原子的配位数之比为8:6=4:3,故答案为:4:3。


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
【题目】用图所示实验装置可以完成中学化学实验中的一些实验。
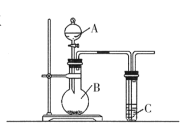
(1)现有稀硝酸、稀盐酸、稀硫酸、碳酸钠粉末、硅酸钠溶液五种试剂。选择三种试剂利用如图装置证明酸性强弱:H2SO4 > H2CO3 > H2SiO3
①仪器B的名称________,A中试剂________,B中试剂________
②C中发生反应的化学方程式:________________________________
(2)利用如图装置实验,证明二氧化硫气体具有漂白性。已知:Na2SO3 + H2SO4=Na2SO4 +SO2↑+H2O。 在装置A中加入 70%的硫酸溶液,B中加入Na2SO3粉末,
①C中应加入________溶液(填“品红”或“石蕊”)。打开分液漏斗活塞,一段时间后观察到C中现象是________________________________,反应完全后,将C试管加热一 段时间发生的现象是________________________
②如果仅用如图装置进行此实验,可能造成环境污染,此污染属于________(选填“白色污染”或“酸雨污染"),因此应该在C装置后加一个盛有________溶液的洗气瓶。
③将二氧化硫气体通入FeCl3溶液中反应一.段时间后,滴加KSCN溶液,溶液未变红色,请写出所发生反应的离子方程式:________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为实现随处可上网,中国发射了“中星16号”卫星。NH4ClO4是火箭的固体燃料,发生反应为2NH4ClO4 ![]() N2↑+Cl2↑+2O2↑+4H2O,NA代表阿伏加德罗常数,下列说法正确的是
N2↑+Cl2↑+2O2↑+4H2O,NA代表阿伏加德罗常数,下列说法正确的是
A. 1mol NH4ClO4溶于水含NH4+和ClO4-离子数均为NA
B. 反应中还原产物分子数与氧化产物分子总数之比为1:3
C. 产生6.4g O2反应转移的电子总数为0.8NA
D. 0.5mol NH4ClO4分解产生的气体体积为44.8L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.由三种元素组成的化合物A,按如下流程进行实验。气体B为纯净物,溶液C焰色反应为砖红色,气体E能使湿润的红色石蕊试纸变蓝。
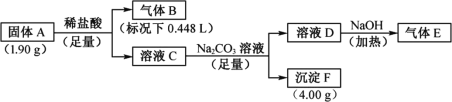
请回答:
(1)组成A的三种元素是________,A的化学式是________。
(2)固体A与足量稀盐酸反应的化学方程式是________。
(3)气体E与甲醛在一定条件下可生成乌洛托品(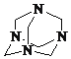 学名:亚甲基四胺),该反应的化学方程式是________(乌洛托品可以用分子式表示)。
学名:亚甲基四胺),该反应的化学方程式是________(乌洛托品可以用分子式表示)。
Ⅱ.某兴趣小组为探究H2S和Cl2O的性质,将两种气体同时通入水中,实验装置如图:
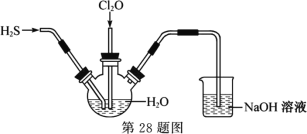
请回答:
(1) 三颈瓶中出现淡黄色沉淀,溶液呈强酸性,用一个化学方程式表示________。
(2) 若通入水中的Cl2O已过量,设计实验方案检验________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化学侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下:
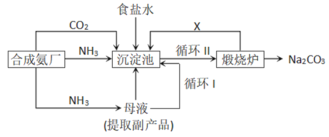
(1)实验室制取氨气的反应方程式为______
(2)上述生产纯碱过程副产品是______。
(3)沉淀池中发生的化学反应方程式是______。
(4)写出上述流程中X物质的电子式______。
(5)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了______(选填循环Ⅰ或循环Ⅱ)的循环。从沉淀池中取出沉淀的操作是_________。
(6)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加________。
查看答案和解析>>
科目:高中化学 来源: 题型:
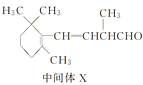
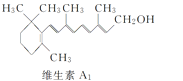
【题目】β紫罗兰酮是存在于玫瑰花、番茄等中的一种天然香料,它经多步反应可合成维生素A1。下列说法正确的是
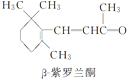 →……→
→……→ →……→
→……→
A.β紫罗兰酮与等物质的量的Br2加成反应可生成2种产物
B.1 mol中间体X最多能与2 mol H2发生加成反应
C.维生素A1难溶于NaOH溶液
D.β紫罗兰酮与中间体X互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化硼(BCl3)是一种重要的化工原料。实验室制备BCl3的原理:
B2O3+3C+3Cl2 =2BCl3+3CO,某实验小组利用干燥的氯气和下列装置(装置可重复使用)制备BCl3并验证反应中有CO生成。(已知:BCl3的熔点为-107.3℃,沸点为12.5℃;硝基苯的密度比水大。)请回答下列问题:
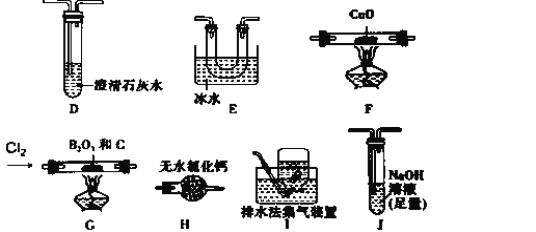
实验Ⅰ:制备BCl3并验证产物CO
(1)BCl3接触潮湿空气时会形成白雾,请写出该反应的化学方程式_______。
(2)该实验装置中合理的连接顺序为G→___→___→__→__→F→D→I;其中装置E的作用是____。
(3)能证明反应中有CO生成的现象是____。
实验Ⅱ:产品中氯含量的测定
①准确称取少许m克产品,置于蒸馏水中完全水解,并配成100mL溶液。
②取10.00mL溶液于锥形瓶中
③加入V1mL浓度为C1 mol/LAgNO3溶液使氯离子完全沉淀;向其中加入少许硝基苯用力摇动。
④以硝酸铁为指示剂,用C2 mol/L KSCN标准溶液滴定过量的AgNO3溶液。重复步骤②~④二次,达到滴定终点时用去KSCN溶液的平均体积为V2mL。
已知:Ksp(AgCl)>Ksp(AgSCN)。
(4)步骤②移取溶液时所需仪器名称为____,步骤④中达到滴定终点的现象为_____。
(5)产品中氯元素的质量分数为_______。
(6)下列操作,可能引起测得产品中氯含量偏高是_____。
A.步骤③中未加硝基苯
B.步骤①中配制100mL溶液时,定容时俯视刻度线
C.用KSCN溶液滴定剩余AgNO3溶液时,滴定前有气泡,滴定后无气泡
D.滴定剩余AgNO3溶液时,KSCN溶液滴到锥形瓶外面一滴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列各小题。
Ⅰ.按要求书写下列化学方程式
(1)2-甲基-1,3-丁二烯与等物质的量的溴发生1,4-加成的反应:_______。
(2)乙醛与新制氢氧化铜悬浊液加热反应:______。
(3)CH3CHClCOOCH2CH3与氢氧化钠水溶液共热:____。
(4)乙二醇和乙二酸脱水成环酯:_____。
Ⅱ.有一种有机物X的键线式如图所示。
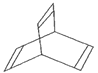
(5)X的分子式为________。
(6)有机物Y是X的同分异构体,且属于芳香族化合物,则Y的结构简式是____。
(7)Y在一定条件下可生成高分子化合物,该反应的化学方程式是___。
(8)X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有____种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国每年产生的废旧铅蓄电池约330万吨。从含铅废料(含PbSO4、PbO2、PbO等)中回收铅,实现铅的再生,意义重大。一种回收铅的工艺流程如下:
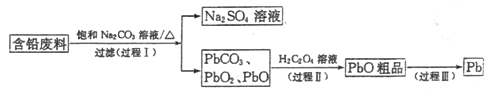
(1)铅蓄电池放电时,PbO2作____极。
(2)过程I,已知:PbSO4、PbCO3的溶解度(20℃)见图l;Na2SO4、Na2CO3的溶解度见如图。
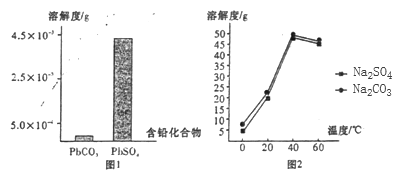
①根据图l写出过程I的离子方程式:__________。
②生产过程中的温度应保持在40℃,若温度降低,PbSO4的转化速率下降。根据如图,解释可能原因:
i.温度降低,反应速率降低; ii.______________(请你提出一种合理解释)。
(3)①过程Ⅱ,发生反应2PbO2+H2C2O4=2PbO+H2O2+2CO2↑。实验中检测到有大量O2放出,推测PbO2氧化了H2O2,通过实验证实了这一推测。实验方案是___________。
(已知:PbO2为棕黑色固体;PbO为橙黄色固体)
②写出H2O2的电子式__________。
(4)过程Ⅲ,将PbO粗品溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液,生成Pb,如图。
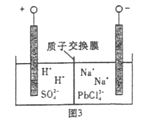
①阴极的电极反应式是____________。
②电解一段时间后,PbCl42-浓度极大下降,为了恢复其浓度且实现物质的循环利用,阴极区采取的方法是_______。
(5)如果用铅蓄电池作电源电解饱和食盐水制取Cl2,已知某铅蓄电池中硫酸溶液的体积为0.8L,电解其按硫酸浓度为4.5mol/L,当制得26.88L Cl2时(指在标准状况下),求理论上电解后电池中硫酸溶液的浓度为________ mol·L-1。(假设电解前后硫酸溶液的体积不变)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com