
【题目】在容积为2L的恒容密闭容器中,一定温度下,发生反应:aM(g)+bN(g) ![]() cQ(g),气体M、N、Q的物质的量随时间的变化如图所示,则下列叙述正确的是
cQ(g),气体M、N、Q的物质的量随时间的变化如图所示,则下列叙述正确的是
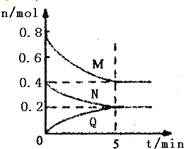
A. 该温度下此反应的平衡常数的值K=25/4
B. 平衡时,M的转化率为50℅,若条件改为恒温恒压,则达平衡时M的转化率小于50℅
C. 若开始时向容器中充入2molM和1molN,达到平衡时,M的体积分数小于50℅
D. 在5min时,再向体系中充入少量He,重新达到平衡前v(正)>V(逆)
【答案】C
【解析】
试题△n(M)=0.8mol-0.4mol=0.4mol,△n(N)=0.4mol-0.2mol=0.2mol,△n(Q)=0.2mol,所以a:b:c=2:1:1,化学方程式为2M(g)+N(g)![]() Q(g),A.平衡时,c(M)=0.4mol÷2L=0.2mol/L,c(N)=c(Q)=0.2mol÷2L=0.1mol/L,K=
Q(g),A.平衡时,c(M)=0.4mol÷2L=0.2mol/L,c(N)=c(Q)=0.2mol÷2L=0.1mol/L,K=![]() =
=![]() =25,故A错误;B.平衡时,M的转化率为50%,若条件改为恒温恒压,由于正方应是体积减小的可逆反应,因此保存恒温恒压有利于平衡向正反应方向进行,则达平衡时M的转化率大于50%,故B错误;C.在该条件下,M的体积分数为:
=25,故A错误;B.平衡时,M的转化率为50%,若条件改为恒温恒压,由于正方应是体积减小的可逆反应,因此保存恒温恒压有利于平衡向正反应方向进行,则达平衡时M的转化率大于50%,故B错误;C.在该条件下,M的体积分数为:![]() ×100%=50%。由于该反应前气体体积大于反应后气体体积,充入比原反应更多的反应物时,可逆反应进行程度比原平衡大,所以M的体积分数小于50%,故C正确;D.向体系中充入少量He,化学平衡不移动,即v(正)=v(逆),故D错误,答案选C。
×100%=50%。由于该反应前气体体积大于反应后气体体积,充入比原反应更多的反应物时,可逆反应进行程度比原平衡大,所以M的体积分数小于50%,故C正确;D.向体系中充入少量He,化学平衡不移动,即v(正)=v(逆),故D错误,答案选C。


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.键能越小,表示化学键越牢固,难以断裂
B.两原子核越近,键长越长,化学键越牢固,性质越稳定
C.破坏化学键时,消耗能量,而形成新的化学键时,则释放能量
D.键能、键长只能定性地分析化学键的特性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生通过测定反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L 的盐酸与50mL0.55mol/L 的 NaOH 溶液在如图所示的装置中进行中和反应。 请回答下列问题:
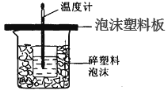
(1)从实验装置上看,图中尚缺少的一种玻璃用品是_________;由图可知该装 置有不妥之处,应如何改正?_____。
(2)实验中改用 60 mL0.50 mol/L 的盐酸跟 50mL 0.55 mol/L 的 NaOH 溶液进行反应,与 上述实验相比,所放出的热量_____(填“相等”或“不相等”);所求中和热的数值会_____(填“相等”或 “不相等”),理由是_____。
(3)该同学做实验时有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因 是_____。
A.测量盐酸的温度后,温度计没有用水冲洗干净 B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓 C.做本实验的当天室温较高 D.在量取盐酸时仰视计数
E.将 50mL0.55mol/L 氢氧化钠溶液取成了 50mL0.55mol/L 的氨水
(4)将 V1ml 1.0mol/L HCl 溶液和 V2ml 未知浓度的 NaOH 溶液混合均匀后测量并记录温 度,实验结果如下图所示(实验中始终保持 V1+V2=50mL)
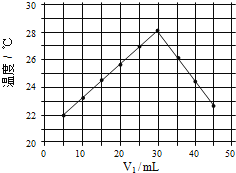
通过分析图像可知,做该实验时环境温度_____(填“高于”,“低于”或“等于”)22℃,该 NaOH 溶液的浓度约为_____mol/L。
(5)假设盐酸和氢氧化钠溶液的密度都是 1g·cm-3,又知中和反应后生成溶液的比热容 c=4.18J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
实验序号 | 起始温度 t1/℃ | 终止温度 t2/℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.2 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.3 | 20.5 | 25.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=_____(结果保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表所示。
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表所示。
t ℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_______________。
(2)该反应为________反应(填“吸热”或“放热”)。
(3)某温度下,各物质平衡浓度符合:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为______。
(4)830 ℃时,容器中的反应已达到平衡。在其他条件不变的情况下,扩大容器的体积。平衡____________移动(填“向正反应方向”“向逆反应方向”或“不”)。
(5)若1 200 ℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2 mol·L-1、2 mol·L-1、4 mol·L-1、4 mol·L-1,则此时上述反应的平衡移动方向为____(填“正反应方向”“逆反应方向”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图是从元素周期表中截取下来的,甲、乙、丙为短周期主族元素,下列说法中正确的是( )
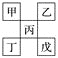
A. 丁一定是金属元素,其金属性比丙强
B. 丙的最高价氧化物水化物显强酸性
C. 乙的氢化物是以分子形式存在,且分子间存在氢键
D. 戊的原子序数一定是甲的5倍,且原子半径比甲大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Mm+与Nn-具有相同的电子层结构,若N的核电荷数为a,M的质量数为A,则M的中子数为__________,两者形成的化合物的化学式可能为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示。下列说法错误的是( )
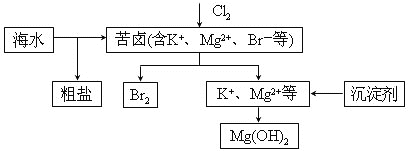
A. 向苦卤中通入Cl2是为了提取溴
B. 工业生产中常选用NaOH作为沉淀剂
C. 粗盐可采用除杂和重结晶等过程提纯
D. 富集溴一般先用空气和水蒸气吹出单质溴,再用![]() 将其还原吸收
将其还原吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2A2(g)+B2(g)![]() 2C3(g);△H=-Q1 kJ/mol(Q1>0), 在一个有催化剂的容积不变的密闭容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
2C3(g);△H=-Q1 kJ/mol(Q1>0), 在一个有催化剂的容积不变的密闭容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
(1)达到平衡时, A2的转化率为____________。
(2)达到平衡后,若向原容器中通入少量的氩气,A2的转化率将________(填“增大“、“减小”或“不变”)
(3)若在原来的容器中,只加入2mol C3,500℃时充分反应达平衡后,吸收热量Q3 kJ,C3浓度___(填>、=、<)w mol·L-1,Q1、Q2、Q3 之间满足何种关系:Q3=____________。
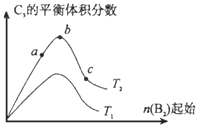
(4)改变某一条件,得到如图的变化规律(图中T表示温度,n表示物质的量),可得出的结论正确的是____________;
a.反应速率c>b>a
b.达到平衡时A2的转化率大小为:b>a>c
c.T2>T1
d.b点A2和B2的物质的量之比为2:1
(5)若将上述容器改为恒压容容器,起始时加入4 molA2和2 molB2,500℃时充分反应达平衡后,放出热量Q4 kJ,则Q2__________Q4(填“>”、“<”或“=”)。
(6)下列措施可以同时提高反应速率和B2的转化率是___________(填选项序号)。
a.选择适当的催化剂 b.增大压强
c.及时分离生成的C3 d.升高温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com