
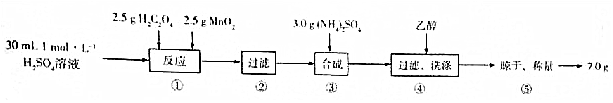
分析 实验室制备硫酸锰铵晶体的:将硫酸与草酸二氧化锰混合,发生反应:MnO2+H2C2O4+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$MnSO4+2CO2↑+2H2O,过滤,得到硫酸锰的溶液,向其中加入硫酸铵,在冰水浴中冷却,过滤,并用少量乙醇溶液洗涤,制得产品,
(1)配制溶液,所需的玻璃仪器有烧杯、玻璃棒、量筒胶体滴管、容量瓶;
(2)步骤①中为二氧化锰与草酸、硫酸反应生成硫酸锰和二氧化碳;溶液不再有气泡冒出时,说明反应已完全;
(3)Mn2+与NaBiO3固体、稀硝酸微热,反应后溶液变紫色,说明有MnO4-产生,同时生成无色的Bi3+,根据电子得失可得;
(4)根据失重率计算0.818g样品中水的质量,加人足量NaOH溶液并加热,收集到标准状况下的气体89.6mL,该气体为氨气,计算铵根离子,所得溶液用盐酸酸化后,加入足量BaC12溶液,得白色沉淀0.932g,该沉淀为硫酸钡,可计算硫酸根离子,据此分析.
解答 解:(1)配制100mL 1mol/LH2SO4溶液,所需的仪器除烧杯、玻璃棒、量筒外,还需要的玻璃仪器是胶头滴管和100 mL容量瓶;
故答案为:胶头滴管和100 mL容量瓶;
(2)步骤①中为二氧化锰与草酸、硫酸反应,二氧化锰有氧化性,被草酸还原为锰离子,草酸有还原性,被还原为二氧化碳,方程式为:MnO2+H2C2O4+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$MnSO4+2CO2↑+2H2O;溶液不再有气泡冒出时,说明反应已完全;
故答案为:MnO2+H2C2O4+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$MnSO4+2CO2↑+2H2O;溶液中不再有气泡逸出;
(3)Mn2+与NaBiO3固体、稀硝酸微热,反应后溶液变紫色,说明有MnO4-产生,锰离子化合价升高,作还原剂,升高五价,同时生成无色的Bi3+,化合价由+5价降低到+3价,作氧化剂,升高2价,升价降价应相等,则反应方程式中锰离子应配5,NaBiO3应配2,则氧化剂与还原剂的物质的量之比为5:2;
故答案为:5:2;
(4)取0.818g样品,加人足量NaOH溶液并加热,收集到标准状况下的气体89.6mL,该气体为氨气,则n(NH4+)=n(氨气)=0.0896L÷22.4L=0.004mol,m(NH4+)=0.004mol×18g/mol=0.072g,
所得溶液用盐酸酸化后,加人足量BaC12溶液,得白色沉淀0.932g,该沉淀为硫酸钡沉淀,故n(SO42-)=n(硫酸钡)=0.932g÷233g/mol=0.004mol,m(SO42-)=0.004mol×96g/mol=0.384g,
在371℃失重率为30.8%,此时已失去全部结晶水,则0.818g样品中,m(H2O)=0.818g×30.8%=0.25g,n(H2O)=0.25g÷18g/mol=0.14mol,
则0.818g样品中,m(Mn2+)=(0.818-0.072-0.384-0.25)g=0.112g,则n(Mn2+)=0.112g÷60g/mol=0.002mol,
故x:y:z:n=0.004:0.002:0.004:0.14=2:1:2:7;[(NH4)xMny(SO4)z•nH2O的化学式为:(NH4)2Mn(SO4)2•7H2O;
故答案为:(NH4)2Mn(SO4)2•7H2O.
点评 本题考查硫酸锰铵晶体的制取及成分的探究,注意从质量守恒的角度分析,加强随数据的处理和分析能力,充分考查学生的分析能力及化学实验能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
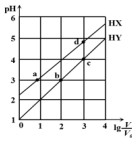 在浓度均为0.1mol/L、体积均为V0的HX、HY,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化关系如图所示.下列叙述正确的是( )
在浓度均为0.1mol/L、体积均为V0的HX、HY,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化关系如图所示.下列叙述正确的是( )| A. | a、b两点的溶液中:c(X-)>c(Y-) | |
| B. | 相同温度下,电离常数K(HX):d>a | |
| C. | 溶液中水的电离程度:d>c>b>a | |
| D. | lg$\frac{V}{{V}_{0}}$=2时,若同时微热两种液体(不考虑HX、HY和H2O的挥发),则$\frac{c({X}^{-})}{c({Y}^{-})}$ 增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用容量瓶配制溶液时,先用蒸馏水洗涤,再用待装溶液润洗 | |
| B. | 用湿润的红色石蕊试纸检验酸性气体 | |
| C. | 用烧杯加热分解Al(OH)3固体 | |
| D. | 用分液漏斗分离乙酸乙酯和饱和碳酸钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 人们习惯上把电解饱和食盐水的工业叫做氯碱工业.
人们习惯上把电解饱和食盐水的工业叫做氯碱工业.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
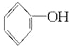 +2Na→2
+2Na→2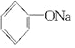 +H2↑
+H2↑ +3Br2→↓+3HBr
+3Br2→↓+3HBr +NaOH→
+NaOH→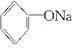 +H2O.
+H2O.| A. | ①和③ | B. | 只有② | C. | ②和③ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烷与2-甲基丙烷的一氯代物均为两种 | |
| B. | 塑料的老化是因为其主要成分在空气中发生了缓慢的加成反应 | |
| C. | 乙醇和乙酸都能与碳酸氢钠溶液反应 | |
| D. | 富含糖类和蛋白质的物质都易被人体消化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌为负极,二氧化锰为正极 | |
| B. | 锌为正极,二氧化锰为负极 | |
| C. | 工作时电子由二氧化锰经外电路流向锌极 | |
| D. | 锌电极发生还原反应,二氧化锰发生氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com