
| A. | 0.1 mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- | |
| C. | pH=1的溶液中:K+、Cr2O72-、CH3CH2OH、SO42- | |
| D. | 由水电离的c(H+)=1.0×10-13mol/L的溶液中:Ba2+、K+、Cl-、NO3- |
分析 A.硝酸钾在酸性条件下能够氧化亚铁离子;
B.甲基橙呈红色的溶液中存在大量氢离子,偏铝酸根离子与铵根离子、氢离子反应;
C.该溶液为酸性溶液,Cr2O72-、CH3CH2OH之间发生氧化还原反应;
D.由水电离的c(H+)=1.0×10-13mol/L的溶液中存在大量氢离子或氢氧根离子,四种离子之间不反应,都不与氢离子、氢氧根离子反应.
解答 解:A.KNO3在存在大量H+的溶液中具有强氧化性,能够氧化Fe2+,在溶液中不能大量共存,故A错误;
B.甲基橙呈红色的溶液为酸性溶液,溶液中存在大量氢离子,NH4+、H+都与AlO2-发生反应,在溶液中不能大量共存,故B错误;
C.pH=1的溶液为酸性溶液,酸性条件下Cr2O72-、CH3CH2OH之间发生氧化还原反应,在溶液中不能大量共存,故C错误;
D.由水电离的c(H+)=1.0×10-13mol/L的溶液为酸性或碱性溶液,溶液中存在大量氢离子或氢氧根离子,Ba2+、K+、Cl-、NO3-之间不发生反应,都不与氢离子和氢氧根离子反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.


科目:高中化学 来源: 题型:选择题
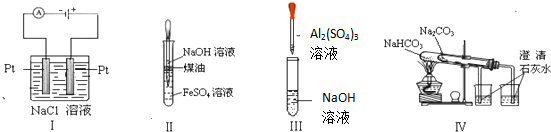
| A. | 实验Ⅰ:制取金属钠 | B. | 实验II:制取Fe(OH)2 | ||
| C. | 实验Ⅲ:制取少量的氢氧化铝 | D. | 实验Ⅳ:比较两种物质的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知2C(s)+O2 (g)═2CO(g)△H=-221kJ/mol,则可知C的燃烧热△H=-110.5kJ/mol | |
| B. | 稀醋酸与0.1 mol/LNaOH溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol | |
| C. | 已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式:2H2O(l)═2H2(g)+O2(g)△H=+285.5kJ/mol | |
| D. | 密闭容器中,9.6g硫粉与11.2g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量.则Fe(s)+S(s)═FeS(s)△H=-95.6kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | C-H | C=C | C-C | H-H |
| 键能(KJ/mol) | 615.3 | 414.4 | 347.4 | 435.3 |
| A. | 已知则可以计算CH3-CH3(g)→CH2=CH2(g)+H2(g);△H=+125.6KJ/mol | |
| B. | NH3+H3O+=NH4++H2O,说明NH3结合H+能力比H2O强 | |
| C. | 室温下,用0.100mol.L-1NaOH溶液滴定20.00mL0.100mol.L-1的醋酸,V(NaOH)=10.00mL时,$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$<1 | |
| D. | 已知中和热为-57.4KJ/mol,则NaOH(aq)+CH3COOH(aq)=CH3COONa+H2O(l)△H=-57.4KJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | a大于0,P1小于P2 | |
| B. | M点H2O(g)的转化率为10% | |
| C. | M点化学反应速率大于N点 | |
| D. | 250℃时,用平衡分压计算的化学平衡常数 KP=$\frac{9}{16}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LCHCl3中含有的氯原子数目为3NA | |
| B. | 46g二氧化氮含有的原子总数一定为3NA | |
| C. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2NHO3+4N2↑+9H2O该反应生成28gN2时,转移的电子数目为4NA | |
| D. | 在密闭容器中加入1,5molH2和0.5molN2,充分反应后可得到NH3分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 酸性锌锰干电池是一种一次性电池,外壳为金属锌,中间是碳棒,其周围是有碳粉、MnO2、NH4Cl等组成的糊状填充物,其结构如下图.该电池在放电时发生的主要反应为:Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH
酸性锌锰干电池是一种一次性电池,外壳为金属锌,中间是碳棒,其周围是有碳粉、MnO2、NH4Cl等组成的糊状填充物,其结构如下图.该电池在放电时发生的主要反应为:Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH| 温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强碱性溶液中:K+、Na+、Cl-、SO42- | |
| B. | 含有0.1mol•L-1Fe3+的溶液中:K+、Mg2+、SCN-、NO3- | |
| C. | 澄清透明的无色溶液:ClO-、MnO4-、Al3+、S2- | |
| D. | 室温下,pH=1的溶液中:Na+、ClO-、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com