
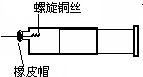
 某同学采用如图装置进行实验,证明了铜与稀硝酸反应生成了NO.实验时,先向注射器内加入一定量的稀硝酸,排净注射器内的空气,迅速将带有铜丝的橡皮帽盖上,一段时间后,注射器内有无色气体产生.
某同学采用如图装置进行实验,证明了铜与稀硝酸反应生成了NO.实验时,先向注射器内加入一定量的稀硝酸,排净注射器内的空气,迅速将带有铜丝的橡皮帽盖上,一段时间后,注射器内有无色气体产生.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:阅读理解
以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程如下:


氯化铵和硫酸钠的溶解度随温度变化如上图所示。回答下列问题:
(1)写出制备 NH4Cl的化学方程式: 。
(2)实验室进行蒸发浓缩用到的主要仪器有 、烧杯、玻璃棒、酒精灯等。
 (3)实验过程中趁热过滤的目的是 。趁热过滤可采用抽滤装置,抽滤装置如图1所示,该装置中的错误之处是 ;若用普通的漏斗,贴上滤纸后,接上抽滤瓶进行吸滤则不行,因为 。
(3)实验过程中趁热过滤的目的是 。趁热过滤可采用抽滤装置,抽滤装置如图1所示,该装置中的错误之处是 ;若用普通的漏斗,贴上滤纸后,接上抽滤瓶进行吸滤则不行,因为 。
![]() (布氏漏斗的使用:一般先在圆筒底面垫上滤纸,将布氏漏斗插进抽滤瓶并将接口密封。抽滤瓶的侧口连抽气系统。然后将欲分离的固体、液体混合物倒进上方,液体成分在负压力作用下被抽进抽滤瓶中,固体留在上方。)
(布氏漏斗的使用:一般先在圆筒底面垫上滤纸,将布氏漏斗插进抽滤瓶并将接口密封。抽滤瓶的侧口连抽气系统。然后将欲分离的固体、液体混合物倒进上方,液体成分在负压力作用下被抽进抽滤瓶中,固体留在上方。)

图1 图2
(4)趁热过滤后,滤液冷却结晶。一般情况下,下列哪些因素有利于得到较大的晶体____。
A.缓慢冷却溶液 B.溶液浓度较高 C.溶质溶解度较小 D.缓慢蒸发溶剂
(5)若NH4Cl产品中含有硫酸钠杂质,进一步提纯产品的方法是 ___。某研究性学习小组为测定该NH4Cl产品中氮的含量,设计了如图2装置,并进行了讨论。
甲同学:根据此实验测得的数据,计算的NH4Cl产品的含氮量可能偏高,因为实验装置中存在一个明显缺陷是:__ ____。
乙同学:实验过程中,往烧瓶中加入的浓氢氧化钠溶液一定要足量并充分加热,原因是 。
用改进后的实验装置重新进行实验,称取13.5gNH4Cl产品,测得实验后B装置增重3.4g。则该化肥含氮量为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com